From Wikipedia, the free encyclopedia
Katalizator – u hemiji i biohemiji – je hemijska supstanca koja pokreće, ubrzava, usporava i/ili usmjerava hemijsku reakciju bez promjena sopstvene strukture na kraju hemijske reakcije. Katalizatori učestvuju u reakciji ali nisu reaktanti niti proizvodi reakcije koju kataliziraju .
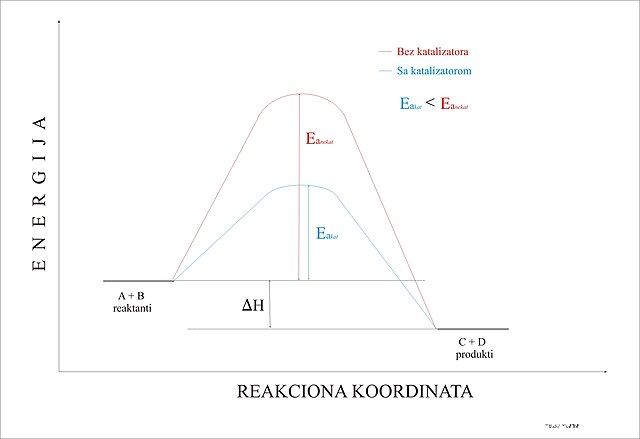
U generalnom značenju, katalizatorom se smatra sve ono što ubrzava reakciju bez sopstvenog trošenja ili mijenjanja (npr. "katalizator političkih promjena"). Djelovanje katalizatora se zasniva na činjenici da oni smanjuju energiju aktivacije reaktanata, čime povećavaju brzinu reakcije, pri čemu ne utiču na termodinamičku ravnotežu reakcije. Katalizatori ne utiču na količinu produkata reakcije nego samo ubrzavaju postizanje ravnotežnog stanja, a djeluju i u malim količinama.
Supstance koje kataliziraju biološke reakcije i procese označavaju se kao biokatalizatori.[1][2][3][4]
Ovakva priroda katalizatotse i katalize objašnjava se time što se između katalizatora i reagirajućih tvari stvaraju nestabilni međuproizvodi, koji nastavljaju reagirati u određenom procesu, nakon kojeg katalizator oslobađa. Oko 90% svih poznatih hemijskih procesa u industriji izvodi se pomoću katalizatora, pri čemu se oko 80% katalizatora označava kao čvrste tvari.
Određene hemijske reakcije, najčešće neke organske sinteze, mogu dati više od jednog produkta. U ovakvim slučajevima se može, izborom pogodnog katalizatora, jedna ili više sporednih reakcija značajno usporiti pri čemu se dobija samo željeni produkt. U zavisnosti od agregatnog stanja reaktanata i katalizatora, kataliza može biti homogena i heterogena.
Homogena kataliza je kataliza u kojoj su reaktanti i katalizatori istog agregatnog stanja. Npr. SO2+1/2O2-NO-->SO3
NO+1/2O2--->NO2 (medjuprodukt) NO2+SO2--->SO3+NO


Heterogeni katalizatori djeluju na drugačiju fazu tvari od reaktanata. Većina ovih katalizatore su čvrsti, a djeluju na podloge u tekućini ili plinovitoj reakcijskoj smjesi. Poznati su različiti mehanizmi za reakcije na površinama, ovisno o tome kako se odvija adsorpcija (Langmuir-Hinshelwoodova, Eley-Ridealova i Mars-van Krevelenova).[5] Ukupno površinsko područje Heterogeni katalizatori djeluju na drugačiji fazu od reaktanata. Katalizatori imaju aktivna mjesta, koja su atomi u kristalnom stanju, gdje se reakcija zapravo i odvija.
Ovisno o mehanizmu, aktivno mjesto svaka plošno izložena površina metala, rub kristala sa nesavršenim metalnim valencama ili komplikovana kombinacija oba. Dakle, ne samo da većina zapremine, već i većina površine heterogenih katalizatora, može biti katalitski neaktivna. Pronalaženje prirodnih aktivnih mjesta je zahtijejevan tehnički izazov istraživanja, koja su u toku.
Naprimjer, u Harberovom procesu, fino podijeljeno željezo služi kao katalizator za sintezu amonijaka, od dušika i vodika. Reagirajući plinovi se adsorbiraju na aktivna mesta čestica željeza. Jednom fizički adsorbirani, reagensi prolaze kroz hemisorpciju koja ezultira u disocijaciji u adsorbiranoj vrsti atoma, a nove veze između nastalih fragmenata se dijelom formiraju zbog njihove neposredne blizine. Na taj način posebno jaka trostruka veza dušika puca, što bi bilo vrlo neobično u fazi plina zbog visoke aktivacije energije. Dakle, energija aktivacije ukupne reakcije se smanjuje, a stopa reakcije povećava. Još jedno mjesto gdje se primjenjuje heterogena katalizator je u oksidaciji sumpor dioksida na vanadij (V) oksidu za proizvodnju sumporne kiseline.
Heterogeni katalizatori su obično "podržani", što znači da se katalizatori raspršuju na drugi materijal koji poboljšava efikasnost ili smanjuje utrošak. Nosač sprečava ili smanjuje nagomilavanje i povezivanje malih čestica katalizatora, izlažući veću površinu, čime katalizatori imaju veću specifičnu aktivnost (po gramu) nosača. Ponekad je nosač sama površina na kojoj se prostire katalizator za povećanje površine. Češće su nosač i katalizator u interakciji i utiču na katalitsku reakciju. Nosači su porozni materijali sa velikom površinom, najčešće glinica, zeolit ili razne vrste aktivnog uglja. Specijalizirani nosači uključuju silicij dioksid, titan dioksid, kalcij karbonat i barij sulfat.
U primjeni elektrohemije, posebno u inženjerstvu gorivih ćelija, koriste se razni katalizatori koji sadrže metal, u cilju poboljšanja stope pola reakcije. Jedna od najčešćih vrsta gorivih ćelija zasniva se na elektrokatalizatorskim nanočesticama platine koje su podržane malo većim česticama ugljika. Kada je u kontaktu sa jednom od elektroda u gorivim ćelijama, ova platina povećava stopu redukcije kisika ili vode, ili u hidroksidu ili vodik peroksidu.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.