From Wikipedia, the free encyclopedia
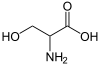
Глицинът е една от двадесетте канонични аминокиселини. Той е най-простата аминокиселина, като страничното му разклонение е един водороден атом. Кодиращите го кодони са GGU, GGC, GGA, GGG.
| Глицин | |
 Химична структура | |
| Имена | |
|---|---|
| Други | аминоетанова киселина аминооцетна киселина |
| Свойства | |
| Формула | C₂H₅NO₂ |
| Моларна маса | 75,032 u[1] |
| Плътност | 1,607 g/cm³ |
| Точка на топене | 233 °C |
| pKa | 2,35 |
| Идентификатори | |
| CAS номер | 56-40-6 |
| PubChem | 750 |
| ChemSpider | 730 |
| DrugBank | DB00145 |
| KEGG | D00011 |
| MeSH | D005998 |
| ChEBI | 15428 |
| ChEMBL | CHEMBL773 |
| ATC | B05CX03 |
| SMILES | C(C(=O)O)N |
| InChI | InChI=1S/C2H5NO2/c3-1-2(4)5/h1,3H2,(H,4,5) |
| InChI ключ | DHMQDGOQFOQNFH-UHFFFAOYSA-N |
| UNII | TE7660XO1C |
| Gmelin | 1807 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Глицин в Общомедия | |
Глицинът не е незаменима аминокиселина за човека и може да бъде синтезиран от аминокиселината серин, която на свой ред се синтезира от 3-фосфоглицерат – метаболит на гликолизата. В повечето организми тази трансаминазна реакция се катализира от ензима серин хидроксиметилтрансфераза, опериращ с кофактора пиродоксал фосфат:[2]
| Серин | FH4 | серин хидроксиметилтрансфераза | Глицин | N5,N10-метилен тетрахидрофолат | |||
 |
+ |  |
 |
+ |  | ||
| H2O | |||||||
 | |||||||
| H2O | |||||||
| серин хидроксиметилтрансфераза | |||||||
В черния дроб на гръбначните глициновата синтеза се катализира от ензима глицин синтаза (известен и като глицин-разделящ ензим). Реакцията е обратима и равновесна.:[2]
| N5,N10-метилен тетрахидрофолат | глицин синтаза | Глицин | |
 |
 | ||
| CO2 NH+ 4 НАДН2 |
FH4 НАД+ | ||
 | |||
| CO2 NH+ 4 НАДН2 |
FH4 НАД+ | ||
Глициновите аминотрансферази могат да катализират синтеза на глицин от глиоксилат и глутамат или аланин. За разлика от останалите аминотрансферазни реакции, глициновите аминотрансферази силно облагоприятстват глициновия синтез. Важни пътища за образуване на глицин при бозайници са от холин и серин.[3]
Комплексът, свързан с разграждането на глицин в чернодробните митохондрии, разгражда глицина до CO2 и NH+
4 и образува N5, N10-метилен тетрахидрофолат. Системата за разграждане на глицин се състои от три ензима и Н-протеин, който има ковалентно прикрепен дихидролипоилен остатък. При некетотична хиперглицинемия (рядко вроден недостатък в глициновото разграждане), глицинът се акумулира във всички тъкани на тялото, включително в централната нервна система. Дефектът в първичната хипероксалурия е неспособността да се катаболизира глиоксилатът, образуван при дезаминирането на глицин. Последващото окисление на глиоксилата до оксалат води до уролитиаза, нефрокалциноза, хипертония или смърт, вследствие на бъбречна недостатъчност. Дефект в бъбречната тубуларна реабсорбция причинява глицинурия.[3]
В повечето белтъци глицинът е слабо застъпен, като забележително изключение прави колагена, който е изграден от над 35% глицин.[2][4] Притежава най-късата странична верига (със само един водороден атом), което определя позицията и в молекулата на колагена – на местата на усукване на трите вериги, аминокиселинните радикали си пречат пространствено.
Глицинът участва в биосинтеза на хем, пурини, креатин и сакрозин.[3]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.