بطارية تدفق
من ويكيبيديا، الموسوعة الحرة
بطارية التدفق أو بطارية تدفق الأكسدة والاختزال هي نوع من البطاريات الثانوية أي يمكن إفراغها و إعادة شحنها وتختلف بشكل كبيرعن البطاريات التقليدية حيث تكون المواد الفعالة مثبتة بشكل صلب على الأقطاب الكهربائية.
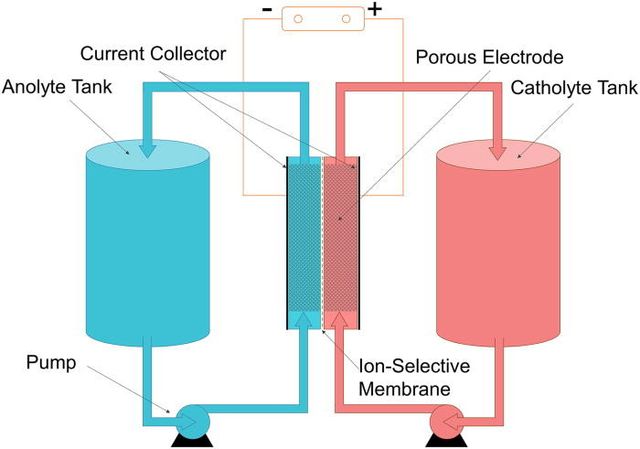
تحتوي بطارية التدفق على قطبين كهربائيين، وخزانين و غشاء أو فاصل يمنع تدفق الإلكترونات بين المحاليل ولكنه يسمح بتدفق الأيونات.
المواد الفعالة للمهبط ( بالإنجليزية : Cathode ) والمصعد ( بالإنجليزية : Anode ) تكون مذابة في الإلكتروليت ، لذا يُشار إليها بالكاثولايت والأنولايت. يتم تدفق محاليل الإلكتروليت بين هذه المكونات بواسطة مضخات.
الأملاح في الإلكتروليت تقوم بدور ناقلات الشحنة. تُمكن البطارية من تخزين الطاقة وإطلاقها مجددًا عن طريق استقبال الإلكترونات وإطلاقها.
تحدث لتفاعلات الأكسدة و الإختزال على سطح الأقطاب الكهربائية. في هذه التفاعلات، يتم نقل الإلكترونات وبالتالي تحويل الطاقة الكهربائية إلى طاقة كيميائية أو العكس.
النوع الأكثر استخدامًا و الأكثرأهمية في بطاريات التدفق حتى الآن هو بطارية التدفق الأكسدة والاختزال للفاناديوم (بالإنجليزية : All-Vanadium Redox-Flow Battery ).[2][3]
آلية عمل بطارية التدفق الأكسدة والاختزال للفاناديوم (بالإنجليزية : All-Vanadium Redox-Flow Battery )
الملخص
السياق
يتكون الإلكتروليت في الخزانات وفي الأقطاب الكهربائية من الماء كمذيب، وحمض الكبريتيك كملح موصل، والذي يساهم في تحسين التوصيل الأيوني في البطارية.
تعتمد الوظائف الأساسية لهذه البطارية على الاختزال والأكسدة لأيونات الفاناديوم، التي تكون في حالات أكسدة مختلفة، في هذا النوع 2، 3 ,4 و 5.
تحدث التفاعلات الرئيسية في الخزانات المنفصلة، حيث يكون كل قطب في محلول إلكتروليت خاص به.
أثناء عملية الشحن، يتم أكسدة الفاناديوم عند القطب الموجب (الكاثود) من حالة الأكسدة الرابعة V(4) (VO2+) إلى الخامسة V(5) (VO2+). في هذه العملية يتم تحرير إلكترون، يتدفق عبر سلك الدارة الخارجية من القطب الموجب إلى القطب السالب.
بالإضافة إلى حركة الإلكترونات، تنتقل أيونات الهيدروجين (البروتونات) عبر الغشاء من القطب السالب إلى القطب الموجب للحفاظ على التعادل الكهربائي في النظام.
في الوقت نفسه، يتم اختزال الفاناديوم عند القطب السالب (الأنود) من حالة الأكسدة الثالثة V(3) (V3+) إلى الثانية V(2) (V2+)، حيث يتم امتصاص الإلكترونات وتخزينها.
عند الحاجة إلى الطاقة، يمكن عكس العملية، بحيث تنتقل الإلكترونات عبر سلك الدارة الخارجية من المحلول المختزل إلى المحلول المؤكسد. تطلق هذه العملية الطاقة الكيميائية المخزنة وتحولها مرة أخرى إلى طاقة كهربائية يمكن إدخالها في شبكة الكهرباء.[3][2]
يتم تحديد جهد الخلية كيميائيًا بواسطة معادلة نرنست وتتراوح في التطبيقات العملية من 1.0 إلى 2.2 فولت.[4]
الإستخدامات
يمكن استخدام بطارية التدفق مثل خلية الوقود (حيث يتم استخراج الوقود المستهلك وإضافة الوقود الجديد إلى النظام)[5] أو مثل البطارية القابلة لإعادة الشحن (حيث يدفع مصدر الطاقة الكهربائية تجديد الوقود).[6] في حين أن لديها مزايا تقنية على عمليات إعادة الشحن التقليدية[7]، مثل الخزانات السائلة التي يمكن فصلها وقرب طول العمر الغير محدود، إلا أن التطبيقات الحالية أقل قوة وتتطلب إلكترونيات أكثر تطوراً.[8]
السعة والقدرة
أحد أهم ميزات بطاريات التدفق بالأكسدة والاختزال هي أن السعة والقدرة قابلان للتوسع و التغيير بشكل مستقل عن بعضهما البعض.
تعتمد السعة، أي كمية الطاقة التي يمكن تخزينها، على كمية الإلكتروليت المخزن في الخزانات الخارجية. يمكن زيادة السعة ببساطة عن طريق تكبير الخزانات و إضافة المزيد من سائل الإلكتروليت.
تعتمد القدرة، أي سرعة توصيل أو استقبال و تخزين الطاقة، على عدد الخلايا في البطارية. تتم زيادة القدرة عن طريق توصيل خلايا إضافية على التسلسل.[9]
تضمن أنظمة المضخات الدوران المستمر لمحاليل الإلكتروليت، مما يوفر تدفقًا منتظمًا. تعتمد كفاءة النظام بشكل كبير على سرعة وتجانس تدفق الإلكتروليت، وكذلك على صيانة المضخات وسلامة نظام الدورة بأكمله.
طالع أيضاً
مراجع
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
