Zwitterioon
From Wikipedia, the free encyclopedia
In chemie is 'n zwitterioon (van duits zwitter, wat beteken "hermafrodiet"), voorheen bekend as'n dipolêre ioon, is 'n molekule met twee of meer funksionele groepe, waarvan ten minste een 'n positiewe en een 'n negatiewe elektriese lading het. Om hierdie rede word zwitterione ook soms interne soute genoem.[1] Wanneer die ladings op die verskillende funksionele groepe mekaar uitbalanseer, is die molekule as 'n geheel elektries neutraal. Die pH waar dit gebeur staan bekend as die isoelektriese punt.[2][3]

In teenstelling met eenvoudige amfoteriese verbindings, wat slegs in die vorm van óf 'n kationiese óf anioniese spesie voorkom, het 'n zwitterion gelyktydig beide ioniese state.[4]
Voorbeelde
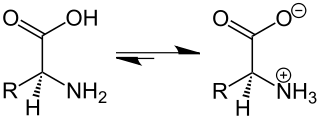
Aminosure is die bekendste voorbeelde van zwitterione. Hierdie verbindings bevat 'n ammonium- en 'n karboksilaatgroep, en kan gesien word as die produk van 'n soort intramolekulêre suur-basis reaksie waar die amien die karboksielsuur deprotoneer:
- NH2RCHCO2H ⇌ NH+3RCHCO−2
Die zwitterioniese struktuur van glisien in die vaste toestand is bevestig deur neutrondiffraksie.[5] Ten minste in sommige gevalle bestaan die zwitterioniese vorm van aminosure ook in die gasfase voort.[6]
Net soos die aminosure, toutomeriseer baie ander verbindings wat beide suur en basiese sentrums bevat, om die zwitterioniese vorm te gee. Sekere voorbeelde soos bisien en trisien bevat 'n basiese sekondêre of tersiêre amienfragment tesame met 'n karboksielsuurfragment. Neutrondiffraksiemetings toon dat vaste sulfaamsuur ook as 'n zwitterioon voorkom.[7] Baie alkaloïede soos LSD en psilosibien bestaan as zwitterione, omdat hulle karboksilate en ammoniumgroepe bevat.
Baie zwitterione bevat kwaternêre ammonium katione. Aangesien hulle nie N–H-bindings het nie, kan die ammonium sentrum nie deelneem in tautomerisasie nie. 'n Tipiese voorbeeld is die betaïene, wat as die elektroliete gebruik word by visse. Die membraan-vormende fosfolipiede is ook algemeen zwitterione. Die polêre kopgroepe in hierdie verbindings is zwitterione, as gevolg van die anioniese fosfaat en kationiese kwaternêre ammonium groepe.[8]

Berekening van die isoelektriese punt
Die pH-waarde by die isoelektriese punt kan bereken word uit die suurdissosiasiekonstantes van die suur en basiese groepe van die zwitterioon (behalwe by hoë verdunning):
Afleiding:
Die suurdissosiasiekonstantes is gedefinieer as:
Vermenigvuldiging van hierdie twee vergelykings elimineer die konsentrasie van die zwitterion:
Omdat die konsentrasies van die anioon en katioon gelyk is by die isoelektriese punt, vereenvouding die vergelyking na:
Deur die vierkantswortel te trek en logaritmes op beide kante te neem, kry ons:
Multiprotiese stelsels
In die geval van suur aminosure (bv. aspartiensuur) of basiese aminosure (bv. lisien), word die pKa-waardes van die twee soortgelyke groepe in ag geneem: in die geval van aminosure met basiese sykettings, kan die syketting en die aminogroup beide 'n positiewe lading by lae pH-waardes aanneem, en in die geval van aminosure met suur sykettings, kan die twee karboksielsuurgroepe beide 'n negatiewe lading by hoë pH waardes aanneem. Die molekule is dus halfpad tussen hierdie twee pK waardes neutraal: wanneer een van die twee soortgelyke groepe neutraal is, sodat die pK waardes van die twee soortgelyke groepe in die vergelyking hierbo ingestel kan word,[9] en die gemiddelde geneem word,[10] byvoorbeeld vir lisien: (8,95 + 10,53)/2 = 9,74[11] en vir aspartiensuur: (2,09 + 3,86)/2 = 2,98.[12]
Verwante verbindings
Die resonans-strukture wat gebruik word om die delokalisering van ladings by dipolêre verbindings voor te stel, sluit normaalweg zwitterioniese strukture in, selfs wanneer daar is nie 'n volledige ladingskeiding is, soos by 'n stabiele zwitterioon nie.[13] Zwitterioniese verbindings, aan die ander kant, het stabiele geskeide elektriese eenheidsladings op verskillende atome.
Verwysings
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





