原子軌域(德語:Atomorbital;英語:atomic orbital),又稱軌態,是以數學函數描述原子中電子似波行為[1][2]。此波函數可用來計算在原子核外的特定空間中,找到原子中電子的機率,並指出電子在三維空間中的可能位置[1][3]。「軌域」便是指在波函數界定下,電子在原子核外空間出現機率較大的區域。具體而言,原子軌域是在環繞著一個原子的許多電子(電子雲)中,個別電子可能的量子態,並以軌域波函數描述。
現今普遍公認的原子結構是波耳氫原子模型:電子像行星,繞著原子核(太陽)運行。然而,電子不能被視為形狀固定的固體粒子,原子軌域也不像行星的橢圓形軌道。更精確的比喻應是,大範圍且形狀特殊的「大氣」(電子),分布於極小的星球(原子核)四周。只有原子中存在唯一電子時,原子軌域才能精準符合「大氣」的形狀。當原子中有越來越多電子時,電子越傾向均勻分布在原子核四周的空間體積中,因此「電子雲」[4]越傾向分布在特定球形區域內(區域內電子出現機率較高)。
在原子物理學的運算中,複雜的電子函數常被簡化成較容易的原子軌域函數組合。雖然多電子原子的電子並不能以「一或二個電子之原子軌域」的理想圖像解釋,它的波函數仍可以分解成原子軌域函數組合,以原子軌域理論進行分析;就像在某種意義上,由多電子原子組成的電子雲在一定程度上仍是以原子軌域「構成」,每個原子軌域內只含一或二個電子。
歷史與命名


早在1904年,日本物理學家長岡半太郎首度發表電子以類似環繞軌道的方式在原子內運轉的想法[5]。1913年,丹麥物理學家尼爾斯·波耳提出理論,主張電子以固定的角動量環繞著體積極小的原子核運行[6]。然而,一直到1926年、量子力學發展後,薛丁格方程式才解釋了原子中的電子波動,定下關於新概念「軌域」的函數[1][7]。
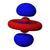
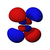
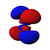
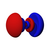
由於這個新概念不同於古典物理學中的軌道想法,1932年美國化學家羅伯特·馬利肯提出以「軌域」(orbital)取代「軌道」(orbit)一詞[8]。原子軌域是單一原子的波函數,使用時必須代入n(主量子數)、l(角量子數)、m(磁量子數)三個量子化參數,分別決定電子的能量、角動量和方位,三者統稱為量子數[1]。每個軌域都有一組不同的量子數,且最多可容納兩個電子。s軌域、p軌域、d軌域、f軌域則分別代表角量子數l =0, 1, 2, 3的軌域,表現出如右圖的軌域形狀及電子排布。它的名稱源於對其原子光譜特徵譜線外觀的描述,分為銳系光譜(sharp)、主系光譜(principal)、漫系光譜(diffuse)、基系光譜(fundamental),其餘則依字母序命名(跳過j)[9][10]。
層次分別
最簡单的電子分佈,以電子層由內至外來算,即是,距离核子的第n層電子層,可容納最多2n2个電子。(電子層數即主量子數n。)
| 由內至外電子層次序 | 電子層符號 | 主量子數 | 亞電子層數目 | 可容納電子數目22 |
|---|---|---|---|---|
| 1 | K | 1 | 1 | 2 |
| 2 | L | 2 | 2 | 8 |
| 3 | M | 3 | 3 | 18 |
| 4 | N | 4 | 4 | 32 |
| 5 | O | 5 | 5 | 50 |
(註:雖然第三、四、五層的電子層可容納電子數目分別為18和32和50,但是它們通常未擠滿電子。例如鉀(K)原子有19個電子,第一層(1s)有2個,第二層(2s2p)有8個,第三層卻不是放進9個電子,而是第三層(3s3p)只放進8個電子,在第四層(4s)再放進1個電子。)
電子層可再細分成亞電子層,其中又以形狀分成五種(隨新元素之發現,往後可能會有第六種),亞電子層也正是原子軌域的集合:
| 由內至外亞電子層次序 | 亞電子層名稱 | 角量子數 | 形狀 | 軌域數目 | 電子數目 | 字母意思 |
|---|---|---|---|---|---|---|
| 1 | s | 0 | 球形 | 1 | 2 | s指Sharp,锐系光谱 |
| 2 | p | 1 | 啞鈴形或吊鐘形 | 3 | 6 | p指Principal,主系光谱 |
| 3 | d | 2 | 雙啞鈴形或吊鐘形 | 5 | 10 | d指Diffused,漫系光谱 |
| 4 | f | 3 | 四啞鈴形或吊鐘形 | 7 | 14 | f指Fundamental,基系光谱 |
| 5 | g | 4 | 八啞鈴形或吊鐘形 | 9 | 18 | g名稱開始依字母排列 |
| 6 | h | 5 | 未發現 | 11 | 22 | h名稱開始依字母排列 |
註:為方便理解,在上表中s軌域的圖是切開一半的。
1s軌域是最靠近原子核的電子軌域,最多可容納两个电子。
原子軌域間的互相作用可形成更複雜的混合形狀,例如在烷烴中的混成軌域。

(亚電子層的「級數」即角量子數,以s軌域為0開始依序增加。)
亚電子層中再分的電子組合,一個軌域只能容納一對電子。在亞電子層內,軌域數目必為奇數,如下表所示。每個軌域以磁量子數代表。
| 由內至外亞電子層次序 | 亞電子層名稱 | 角量子數 | 軌域數目 | 電子數目 | 軌域的磁量子數 |
|---|---|---|---|---|---|
| 1 | s | 0 | 1 | 2 | 0 |
| 2 | p | 1 | 3 | 6 | -1, 0 , +1 |
| 3 | d | 2 | 5 | 10 | -2, -1, 0, +1, +2 |
| 4 | f | 3 | 7 | 14 | -3, -2, -1, 0, +1, +2, +3 |
| 5 | g | 4 | 9 | 18 | -4, -3, -2, -1, 0, +1, +2, +3, +4 |
| 6 | h | 5 | 11 | 22 | -5, -4, -3, -2, -1, 0, +1, +2, +3, +4,+5 |
每個軌域裡最多有2個電子。當正好有兩个電子處於一個軌域時,該對電子的自旋方向必定相反。電子在原子軌域中的自旋方向是自旋量子數,只有+1/2(↑)和-1/2(↓)兩值,即「上旋」和「下旋」之分。
参考文献
參見
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
 ...
... ...
...