酮
来自维基百科,自由的百科全书
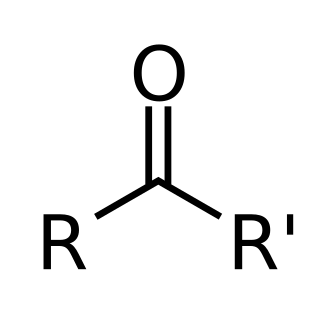

酮是唯一一類羰基碳直接與兩個碳原子相連的有機物。同為羰基化合物的醛、羧酸、酯、醯鹵和醯胺中,羰基碳原子的一側則分別與氫、羥基(氧)、氧、鹵素與氮原子相連。
有α-氫的酮可發生酮-烯醇互變異構。酮與強鹼反應產生相應的烯醇負離子,反應一般通過烯醇去質子化進行。
酮一字在古漢語中意爲「用馬奶製成的酪」和「醋」,近代被用作此類化合物名稱的音譯。
命名
簡單的酮常用普通命名法。
結構和性質

酮中的羰基碳原子為sp2混成,平面三角構型,其C-C-O和C-C-C鍵角約為120°。
羰基中氧原子的電負度高於碳原子的電負度,故羰基有極性,氧原子具親核性,碳原子具親電性。由於羰基能夠與水形成氫鍵,酮分子比羰基置換成亞甲基的分子來說更易溶於水。酮一般只作氫鍵受體而不作為氫鍵供體,無法形成自身分子間的氫鍵,因而比具有類似分子量的醇和羧酸更具揮發性。酮類是常用的香水和溶劑組分。
酮可根據其所含取代基分類,也可根據羰基兩側取代基是否相同而分類為對稱和不對稱的酮。丙酮和二苯酮屬於對稱酮;苯乙酮(C6H5C(O)CH3)則屬於不對稱酮。立體化學中,不對稱酮被視為前手性分子。
按照烴基的不同,酮還可分為脂肪酮,脂環酮和芳香酮。芳香酮的羰基直接連在芳香環上。
按照羰基的數目,酮可以分為一元酮和多元酮。
最簡單的二酮是丁二酮(CH3C(O)C(O)CH3),它曾被用作爆米花中的奶油增味劑。分子對稱的乙醯丙酮(2,4-戊二酮)雖稱為二酮,但它主要以單酮烯醇式存在,此烯醇式是配位化學中的常見配位基。
不飽和酮多指含有烯烴和炔烴結構的酮類。例子有甲基乙烯基酮(CH3C(O)CH=CH2),Robinson環化中的重要中間體。酮官能基自身也是不飽和的,多數情況下可通過氫化還原。
無雜原子取代的飽和單環環酮母核的分子式為(CH2)nCO,其中n=3(環丙酮)-10。環己酮是生產尼龍的前體。異佛爾酮為不飽和的非對稱酮,用於聚合物的製備。麝香酮是一種動物信息素。

至少有一個α-氫的酮可發生酮-烯醇異構化,產生對應的烯醇。異構化可以被酸或者鹼催化進行。通常酮式比烯醇式更穩定,因此可以利用平衡通過炔烴的水解反應來製備酮。
酮的α-氫的酸性(pKa ≈ 20)比一般的烷烴氫的酸性(pKa ≈ 50)強的多。這是因為酮被去質子化後形成的烯醇離子具有一定的穩定性。等當量鹼奪取α-氫後產生的烯醇離子,為兩位負離子,可在親核性較強的碳原子一端也可在鹼性較強的氧原子一端參與親核取代反應,在合成上十分有用。
表徵
在紅外光譜,酮和醛於1700cm−1附近有強烈吸收。具體吸收位置取決於分子中的其他官能基。
酮在核磁共振氫譜中難以確認,在核磁共振碳譜中羰基碳則位於低場約200ppm的位置。因無核極化效應,故信號峰一般較弱。醛和酮在核磁共振中具有相似的化學位移,需通過多重共振實驗進行辨別。
酮的Brady試驗結果呈陽性,可與2,4-二硝基苯肼縮合為相應的腙。Tollens試驗中酮呈陰性,可藉此性質而將酮與醛區分開。甲基酮可通過鹵仿反應鑑別。
合成
酮可通過多種方法合成。工業中,酮多通過烴類被氧化製備,氧化劑一般是空氣(中的氧氣)。例如每年產量十億公斤的環己酮即是通過環己烷被空氣氧化而製備的。而丙酮則是通過異丙苯氧化法來製備的。
實驗室中,酮一般通過二級醇的氧化製備。
- R2CH(OH) + O → R2C=O + H2O
過錳酸鉀與六價鉻試劑(如重鉻酸鉀)是典型的氧化劑。此外還有比較溫和的條件如:使用Dess-Martin氧化或Moffatt-Swern氧化。
許多發展出來的其他常用合成方法包括:
- 通過偕鹵素水解製備。
- 通過炔烴的水解製備。反應經烯醇中間體,需硫酸汞催化。得到的烯醇異構化為酮。這個反應通常是利用末端的炔烴來合成酮。
- 通過計量的有機金屬試劑與Weinreb胺反應。
- 芳基酮可以通過Friedel-Crafts醯化及相關的Houben-Hoesch反應或Fries重排製備。
- 烯烴臭氧化或二羥化-氧化(如Sharpless不對稱雙羥基化反應),可使烯烴斷裂為醛或酮。產物取決於烯烴的雙鍵取代類型。
- Kornblum–DeLaMare重排中,酮通過過氧化物與鹼反應製備。
- Ruzicka環化中,環酮通過二羧酸製備。
- Nef反應中,酮通過二級硝基化合物的鹽的水解製備。
- Fukuyama偶聯中,酮通過硫酯和有機鋅化合物製備。
- 通過醯氯與有機鎘化合物或有機銅化合物反應製備酮。
- Dakin-West反應提供了一種有效的從羧酸來製備酮的方法。
- 酮亦可通過格氏試劑與腈反應然後水解來製備。
- 通過酸酐脫羧來製備。
- 酮可通過鹵代酮的還原脫鹵反應製備。
- α-β不飽和酮可以經由羥醛縮合製備而成。
反應
酮能夠參與許多有機反應。其中最主要的一類就是羰基的親核加成反應以及烯醇對於親電底物的加成反應。親核加成反應包括:
- 與水反應(水解)得到偕二醇。水解平衡在大多數情況下倒向酮一邊,不利於偕二醇的生成。
- 與乙炔化物反應得到α-羥基炔。
- 與氨或一級胺反應得到亞胺。
- 與二級胺反應得到烯胺。
- 與格氏試劑或有機鋰試劑反應,然後用水處理後得到三級醇。
- 與醇或醇鹽反應得到半縮酮或其共軛鹼。此反應常用來保護酮羰基。
- 與胺基鈉反應,C-C鍵斷裂,得到醯胺RCONH2以及烷烴R'H,即Haller-Bauer反應。[2]
- 親電加成,與親電試劑反應得到共振穩定的正離子。
- 與磷葉立德反應得到烯烴,即著名的Wittig反應。
- 與硫醇反應得到硫縮酮。
- 與肼或者1-位取代的肼衍生物反應得到腙。
- 與金屬氫化物反應得到金屬烷氧鹽,水解後得到醇。即酮的還原。
- 與鹵素反應得到α-鹵代酮,反應經烯醇式中間體。參見鹵仿反應。
- 與重水反應得到α-氘代酮。
- 經Norrish反應光解碎裂化。
- 1,4-胺基二酮經Robinson-Gabriel合成,脫水得到㗁唑。
- Willgerodt反應中,芳基烷基酮、硫與胺反應,得到醯胺。
- 與羥胺反應製備肟。
另外,有α-氫的酮可以參與羥醛縮合。
應用
酮在工業中大量用於溶劑、聚合物及醫藥的生產,其中應用最多的是丙酮、丁酮及環己酮。生物化學中酮類亦是常見的物質。烴類在氧氣不足時燃燒,可得酮類及其他各類化合物。
毒性
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


