配位鍵
来自维基百科,自由的百科全书
在配位化學中,配位鍵(coordinate covalent bond)又稱配位共價鍵,簡稱配鍵,是一種特殊的共價鍵。當共價鍵中共用的電子對是由其中一原子獨自供應時,就稱配位鍵。配位鍵形成後,與一般共價鍵無異。
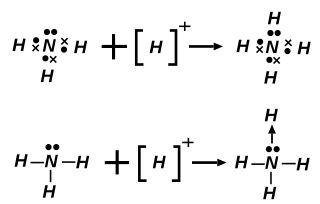
配位作用(coordination)簡稱配位,是化合物的「中心原子或離子」被其他「配位原子或基團」圍繞,並接受配位原子提供的電子對,使中心原子和配位原子形成配位鍵的作用。
相關概念
配位鍵的形成需要兩個條件:
- 一是中心原子或離子,它必須有能接受電子對的空軌域;
- 二是配位體,組成y配位體的原子必須能提供配對的孤對電子(L.P)。
當一個路易士鹼供應電子對給路易士酸而形成化合物時,配位鍵就形成。
例如:
在配位化合物中,由電負性小的元素原子向電負性大的元素原子提供孤對電子形成配位鍵時,每個有一對孤對電子的前者(電負性小的原子)顯示+2價,後者顯示-2價。反之,由電負性大的元素原子提供孤對電子與電負性小的元素原子之間形成配位鍵時,兩種元素都無價態變化。
常見配位鍵化合物
| 這是一篇與化學相關的小作品。您可以透過編輯或修訂擴充其內容。 |
Wikiwand - on
Seamless Wikipedia browsing. On steroids.










