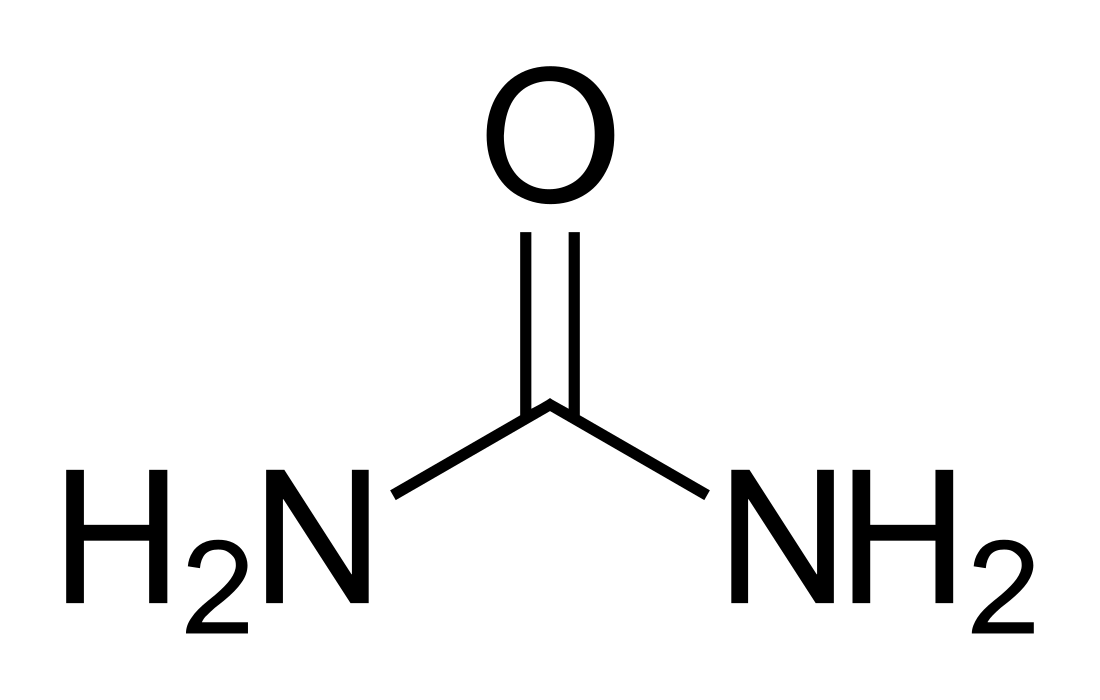
尿素
化合物 来自维基百科,自由的百科全书
尿素(Urea)是由碳、氮、氧和氫組成的有機化合物,又稱脲(與尿同音)。其化學式為 CON2H4、(NH2)2CO 或 CN2H4O,分子質量60,國際非專利藥品名稱為 Carbamide(碳醯胺)。外觀是無色晶體或粉末,是動物蛋白質代謝後的產物,通常用作植物的氮肥。
此條目沒有列出任何參考或來源。 (2018年10月22日) |
此條目缺少或沒有列出參考或來源,或者有未能查證的內容。 (2015年11月13日) |
| 尿素 | |||
|---|---|---|---|
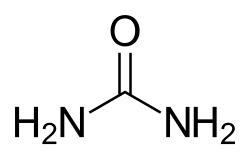
| |||
| |||

| |||
| IUPAC名 carbonyl diamide 碳醯二胺 | |||
| 英文名 | Urea | ||
| 別名 | 脲 碳醯胺 碳醯二胺 二氨基甲醛 二氨基甲酮 | ||
| 識別 | |||
| CAS號 | 57-13-6 | ||
| ChemSpider | 1143 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | XSQUKJJJFZCRTK-UHFFFAOYAF | ||
| Beilstein | 635724 | ||
| Gmelin | 1378 | ||
| DrugBank | DB03904 | ||
| IUPHAR配體 | 4539 | ||
| 性質 | |||
| 化學式 | CH4N2O | ||
| 摩爾質量 | 60.06 g·mol−1 | ||
| 外觀 | 無色無臭固體 | ||
| 密度 | 1.33 | ||
| 熔點 | 132.7 °C(分解) | ||
| 溶解性(水) | 108 g/100 mL (20 °C) 167 g/100 mL (40 °C) 251 g/100 mL (60 °C) 400 g/100 mL (80 °C) 733 g/100 mL (100 °C) | ||
| pKb | 13.82 | ||
| 臨界相對濕度 | 81% (20 °C) 73% (30 °C) | ||
| 結構 | |||
| 晶體結構 | 四方晶系 | ||
| 分子構型 | 平面三角 | ||
| 偶極矩 | 4.56 | ||
| 危險性 | |||
| MSDS | ScienceLab.com | ||
| 主要危害 | 有毒 | ||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化學品 | 雙縮脲、硫脲 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
發現
1727年,荷蘭科學家赫爾曼·布爾哈夫首次在尿液中發現尿素[1],儘管這一發現通常歸功於法國化學家伊萊爾·魯埃勒和蘇格蘭外科軍醫、化學家威廉·克魯克香克 [2]。
1828年,弗里德里希·維勒首次使用無機物質氰酸鉀與硫酸銨人工合成了尿素。本來他打算合成氰酸銨(Ammonium cyanate,NH4NCO),卻得到了尿素。
由此證明了活力論是錯誤的,事實上開闢了有機化學。活力論認為無機物與有機物有根本性差異,所以無機物無法變成有機物。哺乳動物、兩棲動物和一些魚的尿中含有尿素;鳥和爬行動物排放的是尿酸,因為其氮代謝過程使用的水量比較少。
生理
尿素在肝臟產生後融入血液(人體內的濃度在每升2.5至7.5微摩爾/升之間),最後通過腎臟由尿排出。少量尿素由汗排出。
生物以二氧化碳、水、天冬胺酸和氨等化學物質合成尿素。促使尿素合成的代謝途徑是一種合成代謝,叫做尿素循環。此過程耗費能量,卻很必要。因為氨有毒,且是常見的新陳代謝產物,必須被消除。肝臟在合成尿素時,需要N-乙醯穀胺酸作為調節。
含氮廢物具有毒性,產生自蛋白質和胺基酸的分解代謝過程。大多數生物必須對其進行再處理。海生生物通常直接以氨的形式排入海水。陸地生物則將氨轉化為尿素或尿酸再排出。鳥和爬行動物通常排泄尿酸,其它動物(如哺乳動物)則是尿素。例外如,水生的蝌蚪排泄氨,但在其蛻變過程轉為排泄尿素;大麥町狗主要排泄尿酸,不是尿素,因為其尿素循環中的一個轉換酶的基因損壞了。
哺乳動物以肝臟中的一個循環反應產生尿素。這個循環最早在1932年被提出,其反應起點是氨的分解。1940年代澄清瓜胺酸和精氨基琥珀酸的作用後,它已被完全理解。在這個循環中,來自氨和 L-天冬胺酸的氨基被轉換為尿素,起中介作用的是 L-鳥胺酸、瓜胺酸、L-精胺酸-琥珀酸和 L-精胺酸。
尿素循環是哺乳動物和兩棲動物排泄含氮代謝廢物的主要途徑。但別種生物亦然,如鳥類、無脊椎動物、昆蟲、植物、酵母、真菌和微生物。
尿素對於生物來說基本是廢物,但仍有正面價值。比如,腎小管裡的尿素被引入腎皮質以提高其滲透濃度,促使水份從腎小管滲透回身體再利用。
應用
尿素在商業上,可作為:
人類糧食資源與蛋白質的短缺,也造成飼料工業一大難題。業者積極尋找蛋白質的新來源,並擴及蛋白質以外的氮來源,例如含氮量高的尿素。
1897年,Waesk 等人提出反芻動物能轉化非蛋白質氮為菌體蛋白質的想法。1949年,C. J. Watson 等人餵食綿羊含有N15標記的尿素膠囊,4天後在綿羊血液、肝臟、腎臟中檢驗出含有N15的蛋白質。這證實了反芻動物可以利用非蛋白質氮。同年 J. K. Looli 等人以尿素當作唯一氮源餵食綿羊,發現綿羊能夠正氮平衡,表明綿羊瘤胃裡的微生物能利用尿素合成其生長所需的10種必需胺基酸。自此,尿素及尿素化合物成為反芻動物的飼料添加劑。
尿素是製造尿素甲醛樹脂的主要物料,尿素甲醛樹脂是一種透明的熱固性塑膠。在弱基(氨或吡啶)之內加入甲醛和尿素,加熱,經縮合反應,便會合成尿素甲醛樹脂。這種樹脂主要用於刨花板、纖維板和膠合板等人造板的生產。
尿素能非常有效的使蛋白質變性,尤其能非常有效地破壞非共價鍵結合的蛋白質。這特點可以提高某些蛋白質的可溶性,其濃度可達10摩爾體積。尿素也可用來製造硝酸尿素。 尿素也能將王水中的硝酸分離昇華,留下鹽酸來還原四氯金酸溶液,如這時加入硫酸亞鐵粉末將得到沉澱作用,沉澱物質為(海綿金)就是暗褐色黃金粉末
皮膚科以含有尿素的某些藥劑來提高皮膚的濕度。非手術摘除的指甲使用的封閉敷料中,含有40%的尿素。
測試幽門螺桿菌存在的碳-14-呼氣試驗,使用了含有碳14或碳13標記的尿素。因為幽門螺桿菌的尿素酶使用尿素來製造氨,以提高其周邊胃裡的pH值。同樣原理也可測試生活在動物胃中的類似細菌。
尿素是紡織工業在染色和印刷時的重要輔助劑,能提高顏料可溶性,並使紡織品染色後保持一定的濕度。
生產

全世界每年工業的尿素產能約為2.2億噸,中國目前尿素產能在7.4千萬噸左右(全球占比34%)。[3][4] 商業尿素是通過氨與二氧化碳的反應生產的,成品尿素可以為藥片狀、顆粒狀、片狀、晶體或者溶液。尿素一般以藥片或者顆粒的形式上市。
90%以上的生產的尿素被用作肥料。在所有的一般使用的估計氮肥料中尿素的含氮量最高(46.4%),因此相對而言其每氮營養的運輸費最低。尿素在水中的可溶性非常高,因此非常適合被加在可溶的肥料中。
商用尿素的原料是氨與二氧化碳。後者在以焦炭或烴(如天然氣和石油)為原料生產氨的過程中,會大量產生。尿素因此直接從這些原料中產生。
尿素生產是一個平衡的化學反應,其反應物不完全成為反應結果。生產過程、設定的反應條件、如何處理未轉化的反應物,皆可能不同。由於使用大量的反應物,未反應的反應物可用以生產其它產品,(如硝酸銨或硫酸銨),也可回收再投入反應。
實際的合成反應普遍認為應是在液相中分如下兩大步完成的。
第一步是過量的液氨與乾冰反應為氨基甲酸銨。由於是可逆的放熱反應,反應需要帶走熱能的設備。
第二步是加熱氨基甲酸銨為尿素;這步是一個可逆的吸熱反應。反應需要帶走水分的設備。
- -3.6千卡
尿素的反應總式為:
表達在該公式的生產反應總體上為一個可逆的放熱反應。
脲
脲是化合物,含有官能團RR'N-CO-NRR'。這官能團的羰基帶著兩個有機的氨基。實驗室中,光氣可與此二氨基反應。脲類化合物包括過氧化脲、尿囊素、乙內醯脲。脲與雙縮脲非常接近。脲的化學結構與醯胺、氨基甲酸、雙偶氮化合物、碳二亞胺等接近。
其他
參考資料
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.