Loading AI tools
有甜味可使人发笑的氮的氧化物 来自维基百科,自由的百科全书
一氧化二氮,又稱氧化亞氮(英語:Nitrous oxide),俗稱笑氣,化學式為N2O,是一種無色有甜味氣體,在一定條件下能支持燃燒,但在室溫下穩定,有輕微麻醉作用,其麻醉作用於1799年由英國化學家漢弗萊·戴維發現[1]。該氣體早期被用於牙科手術的麻醉,現用在外科手術和牙科。「笑氣」的名稱是由於吸入它會感到欣快,並能致人發笑。一氧化二氮能溶於水、乙醇、乙醚及濃硫酸,但不與水反應。它可以用來作為火箭和賽車的氧化劑,以及增加發動機的輸出功率。在食品行業中,氧化亞氮可作為添加劑,用於打發奶泡與製作咖啡。一氧化二氮是強溫室氣體。現笑氣被用在很多娛樂場所[2]。
此條目需要補充更多來源。 (2014年1月24日) |
| 一氧化二氮 | |
|---|---|

| |
| |
| |
| IUPAC名 Nitrous oxide 氧化亞氮 | |
| 別名 | 笑氣 |
| 識別 | |
| CAS號 | 10024-97-2 |
| PubChem | 948 |
| ChemSpider | 923 |
| SMILES |
|
| InChI |
|
| Beilstein | 8137358 |
| Gmelin | 2153410 |
| UN編號 | 1070(壓縮氣體) 2201(液體) |
| ChEBI | 17045 |
| RTECS | QX1350000 |
| DrugBank | DB06690 |
| KEGG | D00102 |
| 性質 | |
| 化學式 | N2O |
| 莫耳質量 | 44.0128 g·mol⁻¹ |
| 外觀 | 無色氣體 |
| 密度 | 1.2228 g/cm3(液態) 1.8 g/L(氣態,標準狀態) |
| 熔點 | -90.86 °C (182.29 K) |
| 沸點 | -88.48 °C (184.67 K) |
| 溶解性(水) | 0.15 g/100 ml (15 °C) |
| 溶解性 | 易溶於乙醇,醚,硫酸 |
| log P | 0.35 |
| 蒸氣壓 | 5150 kPa (20 °C) |
| 結構 | |
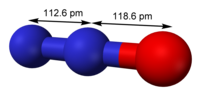
| 分子構型 | 直線型 |
| 偶極矩 | 0.166D |
| 熱力學 | |
| ΔfHm⦵298K | +82.05 |
| 藥理學 | |
| 妊娠分類 | C(美) |
| 藥代動力學: | |
| 5 分鐘 | |
| 危險性 | |
| 警示術語 | R:R8 |
| 安全術語 | S:S38 |
| 歐盟編號 | 氧化劑 [O] |
| NFPA 704 | |
| 閃點 | 非易燃 |
| 相關物質 | |
| 相關化學品 | 一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮、硝酸、亞硝酸 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
一氧化二氮最早是在1772年由英國化學家約瑟夫·普利斯特里合成,他將之稱為「燃素的亞硝酸氣」[3]。普利斯特里將這一發現寫進了他的書《不同類型氣體的實驗與觀察》(1775年),在書中他描述了通過加熱鐵屑和硝酸的混合物來製備這種氣體[4]。
18世紀90年代,漢弗萊·戴維和他的朋友,包括詩人柯爾律治和羅伯特·騷塞試驗了這種氣體。他們發現一氧化二氮能使病人喪失痛覺,而且吸入後仍然可以保持意識,不會神智不清(現代研究表明吸入過量一氧化二氮後會使人神智不清)。
1844年12月11日,一氧化二氮首次被當作麻醉劑在醫學治療中使用,牙醫霍勒斯·威爾士在拔牙過程中使用一氧化二氮減輕病人疼痛[5]。

工業上在約250°C的溫度下小心加熱硝酸銨可以生成一氧化二氮和水蒸汽。[6][7]
硝酸銨的分解也是製備氣體的常用實驗室方法。同樣也可以通過加熱硝酸鈉和硫酸銨的混合物製得:[9]
另一種方法涉及尿素、硝酸和硫酸的反應:[10]
據報道,可用二氧化錳-三氧化二鉍催化劑直接氧化氨:[11]參考奧斯特瓦爾德法。
鹽酸羥胺與亞硝酸鈉反應生成一氧化二氮。如果將亞硝酸鹽添加到羥胺溶液中,則唯一剩餘的副產物是鹽水。但是,如果將羥胺溶液添加到亞硝酸鹽溶液中(亞硝酸鹽過量),則會形成有毒的高級氮氧化物:
連二次硝酸會分解為一氧化二氮和水,在25°C,pH值1–3時的半衰期為16天。 [12]
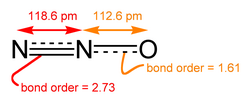
一氧化二氮的分子是直線型結構。其中一個氮原子與另一個氮原子相連,而第二個氮原子又與氧原子相連。它可以被認為是
的共振雜化體。
使用氮氧加速系統的改裝車輛將一氧化二氮送入引擎,遇熱分解成氮氣和氧氣,提高引擎燃燒率,增加速度。氧氣有助燃作用,加快燃料燃燒。
一氧化二氮可以用作火箭氧化劑。比其他氧化劑更好的地方是因為它是無毒的,在室溫下穩定,易於儲存和相對安全地進行飛行。第二個好處是可以很容易分解成幫助呼吸的空氣。
醫生會讓病人吸入一氧化二氮和氧氣,以降低對疼痛的感覺,同時讓病人在清醒狀態。
因不易與奶油中的成分發生反應,多用做奶油發泡劑。
人可能因為在吸入笑氣時氧氣過少而引起突然的窒息。暴露於笑氣中會短時間導致智力,視聽能力,手的靈活度降低。長期接觸可引起維生素B群缺乏症,肌肉麻痺等。
一氧化二氮的主要安全隱患在於,它是一種有分解性的麻醉劑,而且通常以加壓液化的形式儲存。在正常儲存時,它是很穩定的,使用起來也很安全。但是如果錯誤地使用,它會很容易分解而且很有可能爆炸。液態的一氧化二氮是有機物的良好溶劑,不過用它製成溶液有可能會生成一些對外界刺激敏感的爆炸性物質。一部分火箭事故由於一氧化二氮被燃料污染而發生,少量的一氧化二氮和燃料的混合物發生爆炸,隨即引起剩餘一氧化二氮的爆炸性分解。
在中華人民共和國,笑氣被列入《危險化學品目錄(2015版)》,其仍可被用作食品添加劑以及醫用麻醉劑。[13]
氮氧化物,當然也包括一氧化二氮,是一類溫室氣體。因此,氮氧化物是控制溫室氣體排放時(比如京都議定書)的主要對象。一氧化二氮本身是排在二氧化碳、甲烷之後的第三大溫室氣體。它所能造成的溫室效應的效果大約是二氧化碳的200倍[14][15]。在自然條件下,一氧化二氮主要從土壤和海洋中排出。人類耕作、生產、使用氮肥、生產尼龍還有燃燒化石燃料和其他有機物的過程增加了一氧化二氮的排放量。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.