在化學中,極性(polarity),是指一個共價鍵或一個共價分子中電荷分佈的不均勻性。如果電荷分佈得不均勻,則稱該鍵或分子為極性;如果均勻,則稱為非極性。
共價鍵的極性
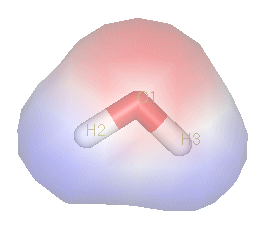
共價鍵的極性是因為成鍵的兩個原子電負度不相同而產生的。電負度高的原子,如氟、氧及氮,比電負度低的原子更能吸引電子,即把電子「拉」向它那一方,而電子接近電負度高的原子的時間也較多,使得電荷不均勻分佈。這樣形成了一組偶極,這樣的鍵就是極性共價鍵。電負度高的原子是負偶極,記作δ-;電負度低的原子是正偶極,記作δ+。兩原子間的極性強度以鍵偶極矩表示。
鍵可以墮入兩個極端——極性和非極性。當構成共價鍵的不同離子的電負度完全相同,便會產生完全非極性的鍵。相反,當兩者的電負度相差值大得足以令其中一種離子完全取走了另一方的一粒電子,就會產生極性鍵——或更貼切而言,是離子鍵。「極性」和「非極性」二詞多用於形容共價鍵上。 鍵的極性程度可以用兩個原子電負度之差來衡量。差值在0.4到1.7之間的是典型的極性共價鍵,差值在0.0到0.4之間的是非極性共價鍵,兩個原子完全相同(當然電負度也完全相同)時,差值為0,這時原子間成非極性鍵。
分子的極性

一個共價分子是極性的,是説這個分子內電荷分佈不均勻,或者説,正負電荷中心沒有重合。分子的極性取決於分子內各個鍵的極性以及它們的排列方式。在大多數情況下,極性分子中含有極性鍵,非極性分子中含有非極性鍵。
然而,非極性分子也可以全部由極性鍵構成。只要分子高度對稱,各個極性鍵的正、負電荷中心就都集中在了分子的幾何中心上,這樣便消去了分子的極性。這樣的分子一般是直線形、三角形(又因三個原子處於同一平面而稱作平面型)或正四面體形。
參見價層電子對互斥理論。 分子的形狀是在組成分子的各原子以及其中某原子的未成鍵電子的相互排斥作用下形成的。相較於化學鍵與鍵之間的排斥力,未成鍵電子對化學鍵的排斥力更大。如二氧化碳(CO2),其中的碳原子和氧原子均達到了八電子穩定結構且所有電子均成鍵,所以沒有額外電子,又因雙鍵的原因碳原子和氧原子都在一條直線上,所以二氧化碳是直線型分子。而氨氣(NH3),因為氮原子有一對電子未成鍵,所以對三對氮氫化學鍵有較大排斥力,因此氨氣分子是三角錐形,而不是平面型或正四面體型。
分子極性對性質的影響
分子的極性對物質溶解性有很大影響。極性分子易溶於極性溶劑,非極性分子易溶於非極性溶劑,也即「同類互溶」。 蔗糖、氨等極性分子和氯化鈉等離子化合物易溶於水。具有長碳鏈的非極性有機物,如油脂、石油的成分多不溶於水,而溶於非極性的有機溶劑。
外部連結
- Chemical Bonding (頁面存檔備份,存於網際網路檔案館)
- Polarity of Bonds and Molecules
- Molecule Polarity (頁面存檔備份,存於網際網路檔案館)
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.