热门问题
时间线
聊天
视角
雙分子親核取代反應
来自维基百科,自由的百科全书
Remove ads
SN2反應(雙分子親核取代反應)是親核取代反應的一類,其中S代表取代(Substitution),N代表親核(Nucleophilic),2代表反應的決速步涉及兩種分子。與SN1反應相對應,SN2反應中,親核試劑帶著一對孤對電子進攻具親電性的缺電子中心原子,形成過渡態的同時,離去基團離去。反應中不生成碳正離子,速率控制步驟是上述的協同步驟,反應速率與兩種物質的濃度成正比,因此稱為雙分子親核取代反應。
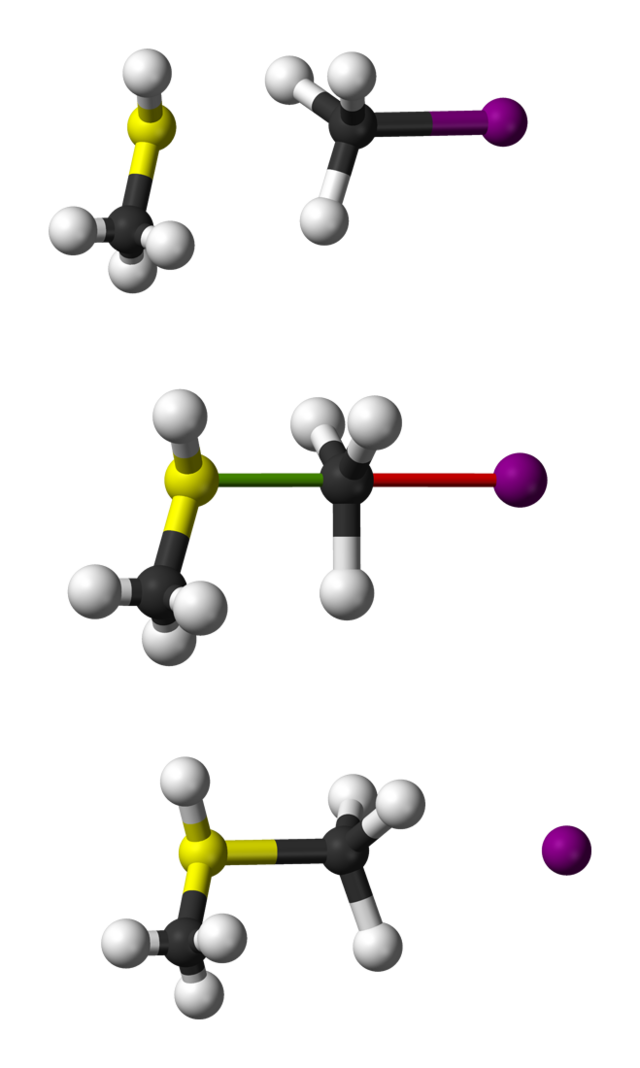
在無機化學中,常稱雙分子親核取代反應類型的反應機理為「交換機理」。
反應機理
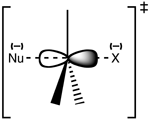
SN2反應最常發生在脂肪族sp3混成的碳原子上,碳原子與一個電負度強、穩定的離去基團(X)相連,一般為鹵素陰離子。親核試劑(Nu)從離去基團的正後方進攻碳原子,Nu-C-X角度為180°,以使其孤對電子與C-X鍵的σ*反鍵軌域可以達到最大重疊。然後形成一個五配位的反應過渡態,碳約為sp2混成,用兩個垂直於平面的p軌域分別與離去基團和親核試劑成鍵。C-X的斷裂與新的C-Nu鍵的形成是同時的,X很快離去,形成含C-Nu鍵的新化合物。
由於親核試劑是從離去基團的背面進攻,故如果受進攻的原子具有手性,則反應後手性原子的立體化學發生構型翻轉,也稱「瓦爾登翻轉」。這也是SN2反應在立體化學上的重要特徵。反應過程類似於大風將雨傘由里向外翻轉。

上例中,OH−(親核試劑)進攻C2H5Br(底物)發生SN2反應,經過不穩定的過渡態,最終Br−離去,得到乙醇。
SN2反應也可以在分子內發生,合成的環系一般為五元環、六元環和三元環。分子內的Williamson合成得到環氧化合物,即是這類反應的一個例子。相比下,四元環張力太大,空間上也不利,很難生成;七元、八元之類的大環可以生成,但分子間反應處於優勢,需要將反應物以高稀溶液的形式反應,以增大分子內產物的比例。
SN2反應一般發生在一級碳原子上,很難成為有位阻分子的反應機理,並且取代基越多,按SN2機理反應的可能性越小。基團在空間上比較擁擠的分子一般採用SN1機理,可以緩解一部分的位阻,也可生成較穩定的碳正離子(通常為三級碳正離子)。
Remove ads
決定速率的因素
- 離去基團的鹼性:離去基團的鹼性越強,其離去能力越弱,反之亦然。離子的鹼性隨著所在週期的增加而降低。對於鹵素離子而言,碘離子的鹼性最弱,因此碘離子是一個很好的離去基團;氟離子則相反,氟代烴也因此很難發生SN2反應。
- 強鹼 F− > Cl− > Br− > I− 弱鹼
- 反應速率 慢 F− < Cl− < Br− < I− 快
- 親核試劑的親核性:親核性需要與上面的鹼性相區別。鹼性是試劑對質子的親和能力,而親核性是試劑形成過渡態時,對碳原子的親和能力。一般來講,試劑的電負度、鹼性和可極化性越強,其親核性也越強,因此反應越快。實際上通常需要綜合考慮這幾個因素以及溶劑的影響。
- 溶劑:SN2反應在質子溶劑中進行時,一方面,溶劑化作用有利於離去基團的離去;另一方面,溶劑也會與親核試劑發生作用,使親核試劑與底物的接觸變得困難。最後的影響是這兩種因素的綜合結果。相對而言,極性非質子性分子很少包圍負離子,因此對SN2反應是有利的。
Remove ads
反應動力學
SN2屬於二級反應,決速步與兩個反應物的濃度相關:親核試劑[Nu−]和底物[RX]。
- r = k[RX][Nu−]
與此相對比的是單分子親核取代反應—SN1反應,親核取代反應的另一種機理。此類反應中,底物中的C-X鍵首先異裂為碳正離子和X−,是較慢的一步,然後親核試劑Nu−立即與碳正離子結合,得到含C-Nu鍵的產物。因此該反應的速率控制步驟只和底物的濃度有關,稱為單分子親核取代反應。
需要注意的是,SN1和SN2只是親核取代反應的兩個比較極端的機理,屬於理想情況。在因素如離子對的影響下,實際中的反應都會或多或少地兼具這兩者機理的成分,有些甚至難以歸類。至於反應按哪種機理進行的成分多一些,與具體的反應物結構、類型、溶劑、濃度、溫度、親核試劑、離去基團等因素都有很密切的關係。
E2競爭
雙分子親核取代反應的一個副反應是E2脫去反應:親核試劑表現鹼性,從底物的β-碳奪取氫離子,底物發生脫去反應生成烯烴。SN2反應與E2反應的共存與競爭可通過以下實驗體現:[1]
上述是磺酸鹽負離子與溴代烷在氣相發生反應的結果。在水溶液中的趨勢是類似的,但還要考慮溶劑效應的影響。當反應物由溴乙烷變為異丁基溴時,位阻大大增加,因此產物也主要變為消除產物。此外,試劑的鹼性越強,也會使脫去反應產物比例增大。若以鹼性更弱的苯甲酸根離子與異丁基溴進行上述反應,取代產物為55%,遠遠高於磺酸鹽負離子反應的15%。
另一種機理
2008年時有人提出了SN2的另一種機理:「迂迴機理」(Roundabout mechanism)。化學家在藉助於「交叉分子束成像法」觀測氯離子和碘甲烷在氣相的反應時發現,當打出的氯離子具有足夠的速度時,反應後碘離子的能量總比預期的要少。根據理論分析推測,能量之所以有損失,是因為氯離子與甲基發生碰撞後,甲基圍繞碘原子需要進行迂迴的轉動,之後才有碘離子的離去以及氯甲烷的生成。[2][3][4]
參見
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

