十二羰基三鐵
化合物 来自维基百科,自由的百科全书
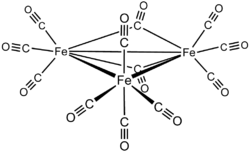
十二羰基三鐵 (英語:Triiron dodecacarbonyl),分子式為Fe3(CO)12。它是第一種人工合成的金屬-羰基簇合物[1]。相比五羰基鐵的化學性質更活潑,更易於分解為單質鐵。
此條目需要補充更多來源。 (2023年1月8日) |
| 十二羰基三鐵 | |
|---|---|
| |
| IUPAC名 dodecarbonyltriiron, tetra-μ-carbonyl-1:2κ4C,1:3κ2C,2:3κ2C- octacarbonyl-1κ3C,2κ3C,3κ2C-triangulo -triiron(3 Fe—Fe) | |
| 別名 | Iron tetracarbonyl trimer |
| 識別 | |
| CAS號 | 17685-52-8 |
| 性質 | |
| 化學式 | Fe3(CO)12 |
| 莫耳質量 | 503.66 g/mol g·mol⁻¹ |
| 外觀 | 深綠色晶體 |
| 熔點 | 165 °C |
| 沸點 | 分解 |
| 溶解性(水) | 不溶 |
| 相關物質 | |
| 其他陽離子 | 十二羰基三釕 十二羰基三鋨 |
| 相關羰基鐵化合物 | 五羰基鐵 九羰基二鐵 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |

性質
十二羰基三鐵為墨綠色晶體,真空下發生升華同時伴隨明顯的分解。溶於非極性溶劑形成深綠色溶液,在空氣氣氛下加熱溶液會使十二羰基三鐵分解形成鐵鏡同時溶液發生自燃。十二羰基鐵的固體在空氣中會緩慢分解,因此通常將其保存在低溫惰性的氣氛中。
合成方法
一種不常用的合成方法是可以通過五羰基鐵的熱分解得到:
3 Fe(CO)5 → Fe3(CO)12 + 3 CO
這種方法的產率低。但是光解五羰基鐵得到的不是十二羰基三鐵,而是九羰基二鐵。
有效合成十二羰基三鐵的方法是以五羰基鐵為原料的[2]:
首先五羰基鐵與有機鹼反應:
3 Fe(CO)5 + (C2H5)3N + H2O → [(C2H5)3NH][HFe3(CO)11] + 3 CO + CO2
得到的金屬羰基氫化物用酸氧化得到產物:
[(C2H5)3NH][HFe3(CO)11] + HCl + CO → Fe3(CO)12 + H2 + [(C2H5)3NH]Cl
最初合成十二羰基三鐵的方式是由德國無機化學家瓦爾特·希貝爾(Walter Hieber)發現的[3]。利用二氧化錳氧化-2價的羰基鐵氫化物H2Fe(CO)4得到零價的十二羰基三鐵:
3 [HFe(CO)4]- + 3 MnO2 → Fe3(CO)12 + 3 OH- + 3 MnO
反應
和大部分金屬羰基配合物一樣,十二羰基三鐵可發生取代反應.比如 Fe3(CO)11{P(C6H5)3}就可以通過十二羰基三鐵與三苯基膦發生取代反應製得 。
安全性
十二羰基三鐵因其是一種易揮發性、可以釋放出一氧化碳的零價鐵化合物而具有危險性。固體的十二羰基三鐵,尤其是細碎的固體粉末和反應後殘餘的十二羰基三鐵可以發生自燃。
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
