構象異構[1](英語:Conformational isomerism,又譯構型異構[2]或結構異構)指由於原子環繞於化學鍵四周,而導致結構式相同,卻具有化學構象或構象異構體之差異的分子現象。

有三種效應,會使某些構象異構物較為穩定:
- 與骨幹相連的各組原子形成交錯(staggered)現象,這是乙烷較常以交叉方式存在的原因。
- 立體排斥現象也會使某些構象異構物較常發生。
- 極性鍵結的鍵矩(bond moments)能使某些構象異構物較穩定。

不同的構象異構物,會因為鍵結位置的旋轉而互相變換,且不會破壞化學鍵。以丁烷為例,其紐曼式投影(右圖)可顯示出主幹(C-C鍵)周圍各鍵結上之分子(C2及C3)之間的夾角變化。旋轉異構物指構象異構物的各形式,旋轉能障(rotation barrier)則為相互變換所需的活化能。
各種構象異構物存在的比例,是依照波茲曼分佈決定:
上式中,i與j為最高能量及最低能量;g為特定能量可產生的構象異構物數量;N為特定構象異構物的所佔分子數量。
有兩種重要的構象同分異構物型態:
- 線性烷烴構象(linear alkane conformation),擁有交錯式(staggered)、重疊式(eclipsed)與間扭式(gauche)。
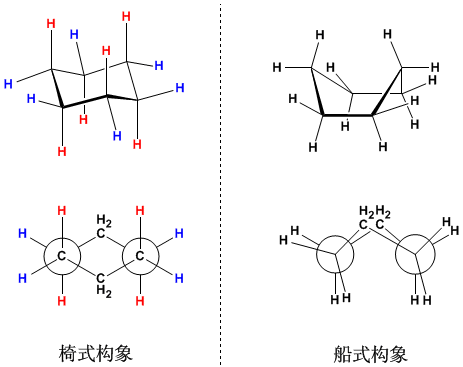
- 環己烷構象(cyclohexane conformation),可分椅式(chair)及船式(boat)。
其他構象同分異構物的例子還有分子的摺疊(folding)現象,會使某些形狀較穩定,並具有某些功能。此外還有旋轉對映異構物(atropisomer)等。
乙烷構象分析
碳碳單鍵的旋轉並不是自由的,受周圍原子大小的影響。產生了有能量高低區分的不同的空間取向方式,稱為構象異構體(rotamer)。能量最小的構象就是分子容易保持的構象。
乙烷的兩個構象如下圖所示。立體效應的解釋是:左邊的重疊式因為氫原子相互離得近,所以原子間相互排斥導致能量比較高;右邊的交叉式則相反,所以能量最低,是最穩定的構象。
兩個構象異構體相差3.0 kcal/mol的能量。
環己烷構象分析
環己烷的構象分析實際上是乙烷構象分析在複雜分子體系延伸和推廣的結果。Barton提出了著名的環己烷椅式構象和船式構象的思想。
環己烷有兩種基本構象, 一個是比較穩定的椅式構象, 一個是較不穩定的船式。由下圖的紐曼投影可以很清楚地看到船式構象的擁擠,不難理解為什麼椅式構象是最穩定的構象。
與乙烷不同,環己烷是環狀分子。環的存在限制了構象的自由旋轉,於是椅式構象環上的氫原子很明顯地分成了兩組。一組是與環平面垂直的豎直鍵(上圖紅色氫原子),即a鍵(axial), 一組是與環平面平行的平伏鍵(上圖藍色色氫原子),即e鍵(equitorial)。這在從紐曼投影式上很容易看出來。由於豎直鍵上的氫原子離較大的亞甲基,即CH2較近,它們受到的空間擁擠比平伏鍵氫原子要大,所以它們所含的能量也較高。
參見
參考資料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.