Loading AI tools
化合物 来自维基百科,自由的百科全书
四碘化鋯是一種無機化合物,化學式為ZrI4。它是橙色固體,遇水分解。它是金屬鋯提純的重要中間體。
| 四碘化鋯 | |
|---|---|
| |
| 英文名 | Zirconium tetraiodide Zirconium(IV) iodide |
| 別名 | 碘化鋯、碘化鋯(IV) |
| 識別 | |
| CAS號 | 13986-26-0 |
| ChemSpider | 75903 |
| SMILES |
|
| InChI |
|
| InChIKey | XLMQAUWIRARSJG-XBHQNQODAZ |
| 性質 | |
| 化學式 | ZrI4 |
| 莫耳質量 | 598.842 g/mol g·mol⁻¹ |
| 外觀 | 吸濕性橙黃色晶體 |
| 密度 | 4.914 g/cm3 |
| 熔點 | 499 °C(772 K)(三相點) |
| 沸點 | 431 °C(704 K)(升華) |
| 結構 | |
| 晶體結構 | 單斜晶系,mP30 |
| 空間群 | P2/c, No. 13 |
| 危險性 | |
| 歐盟分類 | 未列出 |
| NFPA 704 | |
| 相關物質 | |
| 其他陰離子 | 四氟化鋯 四氯化鋯 四溴化鋯 |
| 其他陽離子 | 四碘化鈦 四碘化鉿 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
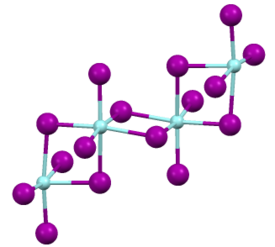
和大多數二元金屬鹵化物一樣,它具有聚合物結構。X射線衍射表明,該化合物是由八面體Zr(IV)中心組成的聚合物,其單體具有一對末端I−配體和四個I−橋配體。 Zr-I的距離為2.692(末端)和3.030 Å。[1][2]
四碘化鋯具有揮發性,以ZrI4四面體分子的形式升華。它可由金屬鋯粉和碘的化合物反應製得。[3]
四碘化鋯在熱金屬絲上的熱分解反應是工業上金屬鋯商業化生產的第一個反應。晶棒法由Anton Eduard van Arkel和Jan Hendrik de Boer在1925年提出。[4]
Zr-I可以形成簇合物,如Zr6I12C、CsZr6I14C等,後者由四碘化鋯、鋯、石墨和碘化銫於850°C的反應製得。[5]B、Al、Si鍵合的Zr-I簇也有報道。[6]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.