Loading AI tools
化學反應中反應物和產物的相對量的計算 来自维基百科,自由的百科全书
化學計量[1](stoichiometry)是化學反應中各物質量的相互關係,即反應物和生成物在化學反應前、反應中和反應後的量之間的關係。化學計量數[2](stoichiometric number)則是化學反應方程式中各物質的係數,是化合物彼此反應的比例關係或數量,即各反應物或生成物前的數值。
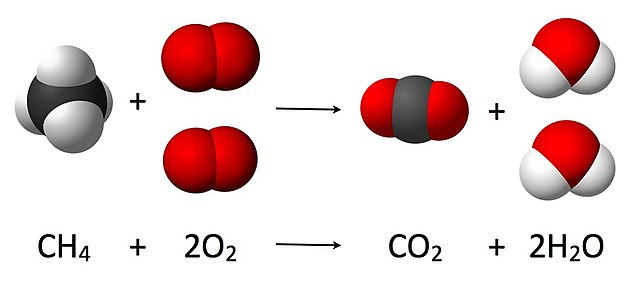
例如,圖中為甲烷在空氣中完全燃燒的方程式,方程式中、前的數值(或「係數」)2就是它的化學計量數。當一個物質前的數值為1時,便省略不寫,如式中的和。
將一個未加化學計量數的方程補充化學計量數,使其符合物質、電荷守恆的過程叫做化學反應方程式的配平。
化學反應方程式中,各反應物的化學計量之比稱為化學計量比(stoichiometric ratio)。如果一個化學反應按照化學計量比發生,我們有如下假設:[3]
一些反應可以按照化學計量比進行反應,如溶液中的離子反應,有一些則需要其中的一種或多種反應物過量,如物質的燃燒。例如,對於反應:
無論哪一個反應物過量,都可以按照化學計量比進行;而對於
在氧氣過量的情況下,碳燃燒生成二氧化碳,而氧氣不足的時候,則有一氧化碳生成。[4]
對於一些反應,可以人為的控制化學計量比,來獲得不同化合物,尤其是一些二元化合物。如紅磷和鈷化合,根據不同的化學計量比,可以產生、和:[5]
燃料在燃燒時,為確保反應完全,需要氧化劑過量。若空氣作為氧化劑,則使燃料完全燃燒所需的空氣與燃料之比成為空燃比。常見燃料的空燃比如下:
有一些反應進行的方式和物量無關,而和反應物的濃度有關,改變反應物的濃度,生成物的種類也隨之改變,如銅和硝酸的氧化還原反應:
在10mol·L-1以上的硝酸中,按上式反應;而在4.8mol·L-1時,按下式反應。此時,無論硝酸或者銅是否過量,反應都按照硝酸的濃度進行,而和其物量無關。[8]類似地,對於硝酸鐵溶液和銀的反應,反應如何進行與硝酸鐵溶液的濃度有關,低濃度時,硝酸鐵水解產生的H3O+與NO3-和Ag反應;而高濃度的硝酸鐵則存在Fe3+氧化Ag和NO3-(H+)氧化Ag的競爭反應,通過理論計算,Fe3+在3.16mol·L-1以上便可氧化Ag。[9]
對於一個已配平的化學反應方程式,已知其中一個參與反應的物量(或其它已知量,如質量等),或者其中一個生成物的物量,便可求出反應方程式中其它物量,這廣泛用於分析化學中的滴定、重量分析的計算中。[10]在物理化學中,如化學反應速率方程的求解與計算中,也能用到化學計量。[11]
而在物質的製備與合成中,往往需要將反應方程式中的化學計量比作為加料多少的參考;對於密閉空間有氣體產生的化學反應,也需要根據生成氣體的量來判斷反應是否安全。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.