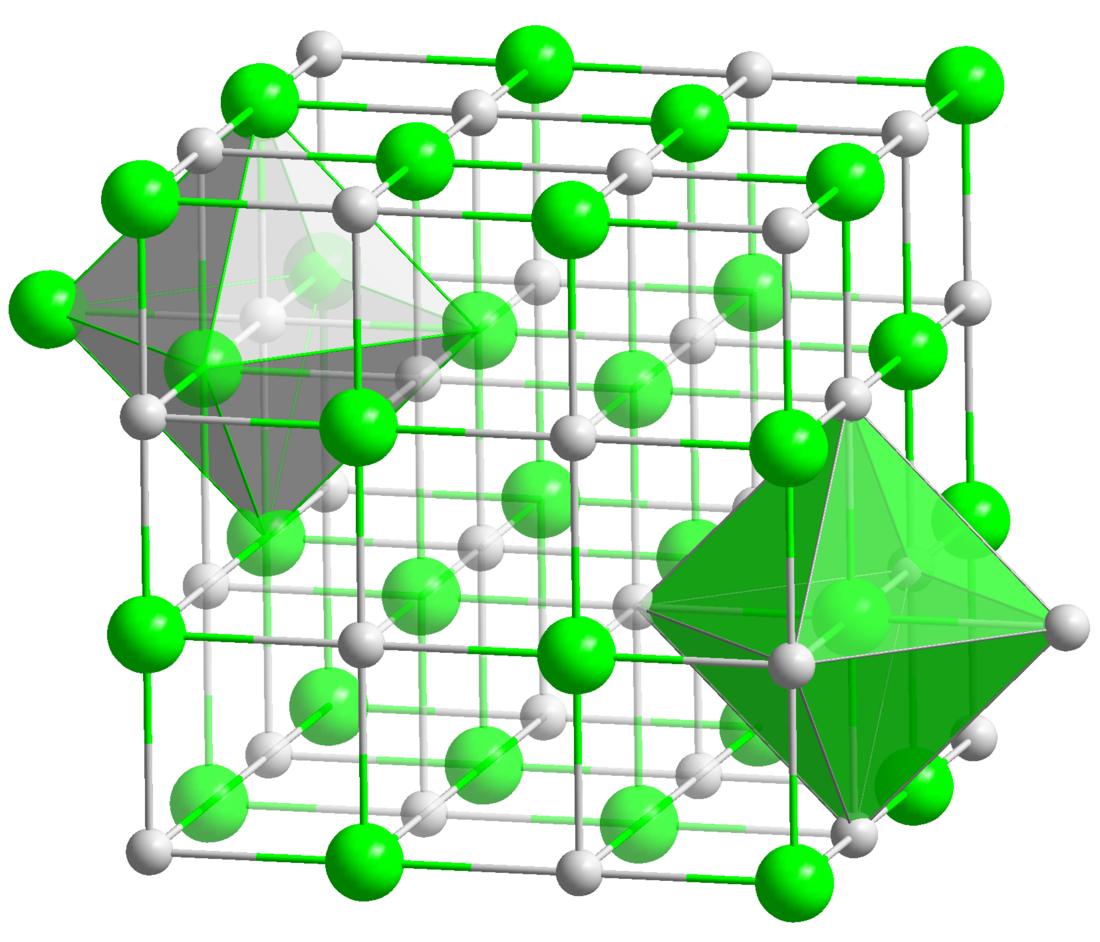
一氧化鈦 (TiO)是一種無機化合物,由鈦和氧組成。它可以由二氧化鈦和金屬鈦在 1500 °C化合而成。[1]它是一種非整比化合物,實驗式 TiO0.7 至 TiO1.3。這是由缺陷岩鹽結構中的Ti或O的空位引起的.[1] 在純TiO中,Ti和O位的15%都處於空位狀態。[1] 小心地退火會導致空位有序,從而產生單斜晶型,該單斜晶型在原始電池中具有5個TiO單元,表現出較低的電阻率。[2] 人們還已知高溫下具有三角稜柱配位的鈦原子的形式。[3] TiO的酸溶液在短時間內穩定,然後分解生成氫氣:[1]
- 2Ti2+(aq) + 2H+(aq) → 2Ti3+(aq) + H2(g)
氣相TiO在較冷恆星(M型)的光譜中顯示出很強的能帶。[4][5] 2017年, TiO 首次在外行星的大氣中被發現。[6] 另外,人們已經獲得證據表明星際介質中存在雙原子分子TiO。[7]
參考資料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.