镤
原子序数为91的化学元素 来自维基百科,自由的百科全书
此条目翻译自英语维基百科,需要相关领域的编者协助校对翻译。 |
此条目尚未参照元素专题之格式编写。 |
镤是在1913年由卡西米尔·法扬斯和奥斯瓦尔德·格林发现,并将其命名为“brevium”(拉丁语,意为短暂、短期),因为当时发现的镤同位素234mPa的半衰期很短。1917至1918年间,莉泽·迈特纳和奥托·哈恩共同发现了一种更稳定的镤同位素231Pa ,半衰期约32000年,因此,他们将该元素的名称变更为镤(protactinium)(proto,希腊文,意为之前;以及actinium,锕元素),因为231Pa是锕同位素227Ac的母同位素。1949年,IUPAC选择了“镤”这一名称,并认定哈恩和迈特纳为镤的发现者。
镤寿命最长且最主要的天然同位素为235U的衰变产物231Pa,半衰期为32760年,远短于地球的年龄,因此所有原始的镤元素,也就是在地球形成时可能存在的镤,至今都已全部衰变殆尽。现今镤在自然界中主要作为铀的衰变产物在铀矿中微量生成,含量非常稀少,在地壳中的平均浓度通常为兆分之一,但在一些晶质铀矿的矿床中可能达到百万分之一。镤因为稀少,且具有高放射毒性,除了科学研究之外没有其他用途。由于天然铀矿中的镤含量非常稀少,作为提取来源并不实际,因此目前研究用的镤主要是从用过核燃料中提取。
历史
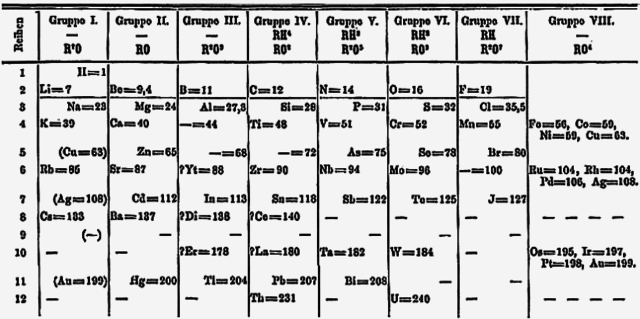
早在1871年,德米特里·门得列夫便预测钍和铀之间有未知元素的存在,并在周期表中预留了位置。[5]由于当时锕系元素的概念还没有被提出,所以在1871年版的门得列夫周期表的排序方式中,钍位于第Ⅳ族,铀位于第Ⅵ族,并在第V族的钽下方的位置留空。这样的编排方式一直持续到1950年代[6],并造成很长一段时间内化学家们都积极在寻找与钽性质相似的新元素,从而使发现镤的机率趋近于零。实际上,下一个与钽有相似化学性质的V族元素为人造元素𬭊。
1900年,威廉·克鲁克斯将硝酸铀酰溶解于乙醚中,发现剩馀的水中含有234Th和另一未知强烈放射性物质。他将它从硝酸铀酰分离,这个物质便是镤。但他不知道他发现了一个新的化学元素,并将其命名为铀-X。[5][7][8]
镤真正首次发现于1913年,当时法扬斯和奥斯瓦尔德·格林,在他们所研究的铀-238衰变链(238U→234Th→234Pa→234U)中,发现了镤的同位素234Pa。因为它的半衰期短只有6.7小时,所以他们将他们发现的新元素命名为Brevium(拉丁语,意思是短暂、短期)。
1917年至1918年间,两组科学家奥托·哈恩和莉泽·迈特纳,以及德国和英国的弗雷德里克·索迪和约翰·克兰斯登,发现了镤的另一个同位素231Pa,半衰期约32000年。因此,他们将名称从Brevium变更为镤(Proto-actinium)(proto,希腊文:πρῶτος,意义为之前、首先),因为镤-231在铀-235衰变链中的位置在锕-227之前,为锕-227的母同位素。
1927年,阿里斯蒂德·冯·格罗斯提取出2毫克的五氧化二镤(Pa2O5),并于1934年首次在0.1毫克的五氧化二镤中分离出纯镤。
英国原子能管理局(UKAEA)在1961年花了50万美元处理了60吨的用过核燃料,提炼出约125克纯度为99.9%的镤[9][10] ,并成为多年来世界上唯一的镤来源,提供给各实验室进行科学研究。[5]镤目前的价格非常昂贵,美国橡树岭国家实验室于2011年公布1克的镤约为280美元。[11]
生成

镤是天然存在的元素中最罕见和最昂贵的元素之一。由于235U的α衰变(会产生镤-231),以及238U的β衰变(产生镤-234),因此自然界的镤通常是以231Pa和234Pa的形式存在。自然界中的铀以238U为主(占天然铀的99.284%),而几乎所有的238U(99.8%)都会衰变成234mPa,但由于234Pa和234mPa的半衰期都极短,会很快地衰变成234U,因此自然界中丰度最高的镤同位素为长寿的231Pa,约占天然镤的100%。
镤-233是钍-232发生中子俘获所形成的。而它会再衰变成铀-233,或者捕捉另一个中子,并转换成非裂变的铀-234。
镤在方铀矿(沥青铀矿)中的浓度约为0.3至3 ppm(百万分点浓度),大部分为0.3ppm,但部分从刚果民主共和国出产的铀矿中镤的浓度可达3 ppm。在大多数的天然材料和水中,镤以兆分之一以下的浓度均匀分布,放射性约为0.1皮居里/克。
制备
在核反应堆出现之前,镤是从铀矿石用科学实验方法分离。如今,它主要是钍的高温反应器中的中间产物:
在核反应堆中,可以利用慢中子照射钍-230而将其转化为钍-231,或利用快中子照射钍-232生成钍-231和2个中子,随后钍-231快速发生负β衰变生成镤-231。
物理及化学性质
镤是银灰色光泽的金属,可保存于空气中一段时间。
镤在周期表中位于钍的右侧、铀的左侧,而其物理性质正介于这两个锕系元素之间。镤的密度比钍大,而比铀小;其熔点低于钍,而高于铀。这三个元素彼此的热膨胀、电导率和热导率相当,表现出典型的贫金属特征。估计镤的剪切模量与钛相近。[15]
在室温下,镤是体心四方结构,其可被视为扭曲的体心立方晶格结晶:而这种结构在被压缩至高达53 GPa时仍不会改变。从大约1200°C的高温冷却后,其结构变为面心立方(fcc)。[12][16]从室温至700°C之间其四方相的热膨胀系数为9.9×10-6/°C。[12]
镤具有顺磁性,且在任何温度下都不会发生磁跃迁。[17]它在温度低于1.4K时将成为超导体。[5][13]四氯化镤在室温下是顺磁性的,但在冷却至182K后会转为铁磁性。[18]
无论是在固体和水溶液中,镤存在两个主要的氧化态:+4和+5,而+3和+2态的镤也在一些固相中被观察到。由于它的电子排布是[Rn]7s26d15f2,+5氧化态对应的低能量有利于5f0的电子填入。+4和+5态的镤都很容易在水中形成氢氧化物,主要离子包括Pa(OH)3+、Pa(OH)2+
2、Pa(OH)+
3以及Pa(OH)4,皆为无色的。其他已知的离子包括PaCl2+
2、PaSO2+
4、PaF3+、PaF2+
2、PaF−
6、PaF2−
7以及PaF3−
8。
化合物
| 化学式 | 颜色 | 结构 | 空间群 | 空间群编号 | 皮尔逊符号 | a (pm) | b (pm) | c (pm) | Z | 密度, g/cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pa | 银灰 | 四方晶系 | I4/mmm | 139 | tI2 | 392.5 | 392.5 | 323.8 | 2 | 15.37 |
| PaO | 岩盐[14] | Fm3m | 225 | cF8 | 496.1 | 4 | 13.44 | |||
| PaO2 | 黑 | 面心立方[14] | Fm3m | 225 | cF12 | 550.5 | 4 | 10.47 | ||
| Pa2O5 | 白 | Fm3m[14] | 225 | cF16 | 547.6 | 547.6 | 547.6 | 4 | 10.96 | |
| Pa2O5 | 白 | 斜方晶系[14] | 692 | 402 | 418 | |||||
| PaH3 | 黑 | 立方晶系[14] | Pm3n | 223 | cP32 | 664.8 | 664.8 | 664.8 | 8 | 10.58 |
| PaF4 | 红棕 | 单斜晶系[14] | C2/c | 15 | mS60 | 2 | ||||
| PaCl4 | 黄绿 | 四方晶系[19] | I41/amd | 141 | tI20 | 837.7 | 837.7 | 748.1 | 4 | 4.72 |
| PaBr4 | 棕 | 四方晶系[20] | I41/amd | 141 | tI20 | 882.4 | 882.4 | 795.7 | ||
| PaCl5 | 黄 | 单斜晶系[21] | C2/c | 15 | mS24 | 797 | 1135 | 836 | 4 | 3.74 |
| PaBr5 | 红 | 单斜晶系[22] | P21/c | 14 | mP24 | 838.5 | 1120.5 | 1214.6 | 4 | 4.98 |
| PaOBr3 | 单斜晶系 | C2 | 1691.1 | 387.1 | 933.4 | |||||
| Pa(PO3)4 | 斜方晶系[23] | 696.9 | 895.9 | 1500.9 | ||||||
| Pa2P2O7 | 立方晶系[23] | Pa3 | 865 | 865 | 865 | |||||
| Pa(C8H8)2 | 金黄 | 单斜晶系[24] | 709 | 875 | 1062 |
a,b和c是晶格常数,单位为皮米;Z是每单位晶格中的首栏化学式数目。
同位素
目前已发现29种镤的同位素,全部都具有放射性。其中最稳定的是231Pa,半衰期为32760年,233Pa的半衰期为27天,230Pa的半衰期为17.4天。其它的大部分都小于1.6天,其中的大部分又小于1.8秒。镤还有两个核异构体:217mPa(半衰期 1.2毫秒)和234mPa(半衰期 1.17分)。[25]
镤主要有两种衰变模式:较轻同位素(211Pa至231Pa)的主要衰变模式为α衰变,产物多为锕的同位素;较重同位素(232Pa至240Pa)的主要衰变模式为β衰变,产物为铀的同位素。[25]
应用
虽然元素周期表中位于镤前后的钍和铀由于半衰期长且存量丰富而都有着广泛的应用,但镤本身由于存量稀少,且具有高放射性和高毒性,目前在科学研究之外没有其他用途。[26]
镤-231是由核反应堆中铀-235发生α衰变所产生,或者由以下反应232Th + n → 231Th + 2n,接着231Th发生β衰变生成。它曾经被认为能够维持核连锁反应,理论上可以用来制造核武器,物理学家沃尔特·塞弗里茨曾估计其临界质量为750±180公斤。[27]然而,由于难以制成如此大量的镤,以镤制造核武器的可能性已被排除。[28]
随着高灵敏度质谱仪的面世,镤开始在地质学和古海洋学中用作示踪剂,可透过沉积物中镤-231和钍-230的比例对其进行年代测定,并用于模拟矿物的形成。[29]使用此法测定海洋沉积物的年代,可让科学家们能够重建冰河时期冰川最后一次融化期间北大西洋水体的流动。[30]一些与镤相关的年代测定依靠于对铀衰变链中几个长寿命同位素的相对浓度的分析,例如铀、镤和钍。这三个元素分别具有6、5和4个价电子,因此易形成+6、+5和+4氧化态,并表现出不同的物性和化性。其中钍和镤的化合物难溶于水,会沉淀成沉积物,而铀则否,且钍的沉淀速率比镤快。分析镤-231(半衰期32760年)和钍-230(半衰期75380年)的浓度比例与仅测量一种同位素的浓度相比,可以提高年代测定的准确度。此外,这种双同位素测定法受同位素空间分布的不均匀性及其沉淀速率的变化性影响较小。[29][31]
安全
镤在人体中不发挥任何生物学作用[32],但由于其具有高度的放射性,对生物体具有很高的毒性,因此须在密封的手套箱进行操作。其最稳定的同位素镤-231的活性比度为每克0.048居里(1.8GBq),主要会发射能量为5MeV的α粒子,用任何材料的薄片或皮肤即可阻挡,通常只有在被摄入体内时才会对健康构成危害。[32]然而它会慢慢地衰变成锕-227,半衰期为32760年。锕-227的活性比度为每克74居里(2700GBq),会同时发射α及β粒子,半衰期仅22年。锕-227接着会衰变成一些半衰期更短、活性比度更大的放射性同位素,最终衰变成稳定的铅-207。其衰变链整理于下表:
镤是微量存在于自然界中的天然元素,可通过进食、饮水或呼吸空气进入体内。当吸入时,很大一部分的镤可以从肺部透过血液移动到其他器官,这取决于该镤化合物的溶解度。[32]通常人体内沉积的镤可能是肠胃道从食物和饮水中吸收而来,摄入体内的镤中只有大约0.05%会进入血液,其余的则会被排出体外。血液中的镤有大约40%进入骨骼中,约15%进入肝脏,2%进入肾脏,其余的被排泄出体外。镤在骨骼中的生物半衰期约为50年,而在其他器官中,其排泄动力学具有快速和缓慢的组成部分。例如肝脏中70%的镤的生物半衰期为10天,剩下的30%为60天;肾脏的相应值则为20%(10天)和80%(60天)。在镤处于这些器官中的期间内,其放射性会持续增加癌症产生的风险。[26][33]镤在人体内的最大放射性活度安全剂量是0.03微居里(1.1kBq),相当于0.5微克镤-231的放射性,这种同位素的毒性是氢氰酸的2.5×108倍。[34]在德国,镤-231在空气中的最大允许浓度为3×10-4 Bq/m3。[33]
参考资料
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






![{\displaystyle \mathrm {^{232}_{\ 90}Th\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 90}^{233}Th\ {\xrightarrow[{22.3\ min}]{\beta ^{-}}}\ _{\ 91}^{233}Pa\ {\xrightarrow[{26.967\ d}]{\beta ^{-}}}\ _{\ 92}^{233}U} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/721d2b9fd9152c99eb0a1e923c8d54972a5e464a)