RNA溫度計
来自维基百科,自由的百科全书
RNA温度计(RNA thermometer),亦称RNA温度传感器(RNA thermosensor)是一类对温度敏感的非编码RNA,能随温度变化调控基因表达。RNA温度计主要调控与热休克和冷休克反应有关的基因,但与致病性、饥饿状态等过程相关的基因调控也有关系[1]。

RNA温度计一般通过二级结构的改变对温度变化做出反应。结构的改变会使RNA上核糖体结合位点等重要区域暴露或遮蔽,进而改变对应编码基因的翻译速率。
RNA温度计与核糖开关一样,都是支持RNA世界假说的有力证据。RNA世界假说认为RNA为早期生命的唯一组成成分,但随生物进化,RNA携带遗传信息的功能由DNA取代,RNA的生物催化活性由蛋白质取代,形成了今日的DNA-RNA-蛋白质系统[2][3]。
RNA温度计的实例有FourU温度计[4]、Hsp90顺式作用元件[5]、ROSE元件[6]以及Hsp17温度计[7]。
发现
温度敏感的RNA元件于1989年首次发现[8]。不过,早在1986年,研究人员就发现λ噬菌体cIIImRNA转录开始位点上游的突变会影响cIII蛋白质的翻译速率[9]。cIII蛋白质与λ噬菌体对溶原性循环和裂解循环的选择有关,高浓度的cIII蛋白能促进溶原化[9]。进一步的研究表明cIII mRNA上游区域一定存在两种二级结构之一。实验表明,这两种结构可以完全互换,其活性都依赖镁离子浓度和温度[8][10]。现在已知该结构就是RNA温度计。该结构的作用即促进噬菌体在高温压力下转入裂解循环,以保证噬菌体能快速复制,脱离原宿主细胞[1]。
RNA温度计这一名词是在1999年提出的[11],最初, 该名词用于描述大肠杆菌中发现的RNA元件rpoH[12]。2007年,研究人员通过生物信息学手段发现了一些可能为新的RNA温度计的序列[13]。使用传统的序列-碱基搜寻方法找寻RNA温度计效率很低,因为RNA温度计的二级结构比一级结构(核酸序列)保守得多[13]。
分布
目前的观点认为,大部分RNA温度计都位于编码热休克蛋白(HSP)的mRNA的5'端非翻译区(UTR)。但有研究人员提出,在基因组数据中找寻非保守的短RNA序列本身就很难,加上采样可能出偏差,因而得出了上述(不准确的)结论[14][15]。
尽管绝大部分RNA温度计都是在原核生物中发现的,但科学家亦于包括人在内的哺乳动物体内发现了可能为RNA温度计的非编码RNA[16],即热休克RNA-1(HSR1)。在人体内,这种RNA分子在温度超过37摄氏度(即人的正常体温)时能活化热休克转录因子-1(HSF1)基因的表达,进而激活保护性蛋白的表达,达到防止细胞过热的目的[16]。
结构

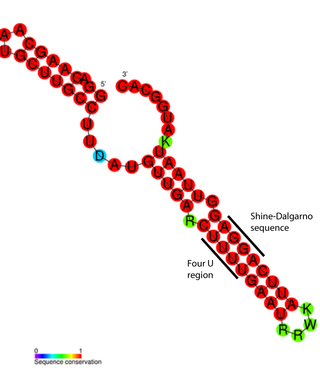
RNA温度计结构上很简单,短RNA序列就能构成。目前已知最短的RNA温度计发现于某种集胞藻体内(Synechocystis sp. PCC6803),只有44个核苷酸残基(44nt)长,为编码热休克蛋白hsp17的mRNA[18][19]。大部分RNA温度计的长度都介于60-110nt之间[20]。RNA温度计通常都含有发卡结构(茎环结构)。RNA温度计的发卡结构因为有少量的错配碱基对,稳定性较差,因此在温度升高后很容易去折叠[21]。
对RNA温度计ROSE元件的具体结构分析表明,G-G、U-U、UC-U等错配的碱基对之间以非标准的碱基配对连结,有利于RNA双螺旋结构的维持(如左图所示)。另外,这些非常规的碱基配对稳定性较差,温度升高后,很容易就解开,使SD序列暴露[17]。
一些RNA温度计的结构远比一个单一的发卡结构复杂,比如,研究人员推测CspA mRNA5'端非翻译区含有一个假结与多个发卡结构[22][23]。
人工合成的RNA温度计通常都设计成只含有一个简单茎环结构[24]。然而,这样的短RNA温度计的二级结构对突变很敏感,即使是一个碱基对的变化(点突变)也可能造成其茎环结构在体内(in vivo)失活[25]。
机理

RNA温度计一般位于mRNA5'端非翻译区,即编码基因的上游[1]。位于此处使得RNA温度计能遮蔽核糖体结合位点(RBS),阻止mRNA翻译为蛋白质[14]。随温度增加,茎环结构会解旋,使核糖体结合位点或SD序列暴露,使得mRNA能与核糖体30S亚基(小亚基)结合。紧接着,翻译机器会完成组装[1]。起始密码子一般位于SD序列下游8个核苷酸残基处[14]。从起始密码子开始,翻译正式开始,核糖体随后能翻译出一整条多肽链,到终止密码子为止[26]。除了这种顺式作用机理外,在饥饿反应相关的RposS mRNA 5'非翻译区中还发现了一个使用反式作用机理的特例。[1]。
RNA温度计的一个特例是肠道沙门氏菌(Salmonella enterica)体内发现的FourU[4]。当处于大约45摄氏度的环境中时,SD序列所在区域的“茎”结构碱基配对会解开,使mRNA能与核糖体结合,启动翻译[25]。已证明FourU的稳定性与Mg2+的浓度有关[27]。目前,研究得最透彻的RNA温度计位于大肠杆菌(E. coli)的rpoH基因中[28]。该RNA温度计能在高温环境下通过一种特殊的热休克σ因子σ32上调热休克蛋白的表达水平[11]。
一般来说,RNA温度计都与热诱导蛋白质的表达有关,不过,RNA温度计也能调控冷休克蛋白质的表达[22]。比如,嗜热栖热菌(Thermus thermophilus)中两种7kDa的蛋白质的表达就受RNA温度计的调控[29],另外,在肠杆菌目中也发现了类似的调控机制[23]。
病原体可利用对37摄氏度的温度敏感的RNA温度计激活感染相关基因的表达[14]。比如,在李斯特菌细胞内,一种调控与毒性相关的基因转录的关键蛋白由prfA基因编码。研究人员设计了以下实验证明RNA温度计对prfA表达的上调:将PrfA温度调控非翻译区与绿色萤光蛋白基因融合,再将其置于大肠杆菌的T7启动子调控之下。于37摄氏度下,可以观察到绿色萤光蛋白的表达,而在30摄氏度下无法观察到[30]。
对RNA世界学说的影响
RNA世界学说认为在早期生命中,RNA既是遗传信息的载体,又具有生物催化活性。另外,还有RNA扮演基因表达调控和感受器的角色[31]。该学说认为,现在的DNA-RNA-蛋白质系统是由上述原始的RNA生物进化而来,因为DNA-RNA-蛋白质系统相对原始的RNA生物具有优势,使用DNA-RNA-蛋白质系统的生物在自然选择中胜过了RNA生命,成为现代生命的形式。DNA-RNA-蛋白质系统中,RNA携带遗传信息的功能由DNA取代,其生物活性则由蛋白质取代。但仍然保留有部分具有催化活性的RNA,即核酶[2]。
RNA温度计以及核糖开关因为其广泛分布于各物种之中,都被认为是RNA生命向现代的DNA-RNA-蛋白质系统过渡时产生的进化遗迹[32]。一般认为,在早期的RNA世界中,RNA温度计的作用是对其他的RNA分子进行温度依赖性的调控[2][33]。在现代生物中,RNA温度计可以说是一个RNA世界的良好分子化石[2]。
其他实例
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.