组蛋白(英语:histone,或称组蛋白)是真核生物体细胞染色质与原核细胞中的碱性蛋白质,和DNA共同组成核小体结构[1][2][3]。它们是染色质的主要蛋白质组分,作为DNA缠绕的线轴,并在基因调控中发挥作用,但是原核细胞组蛋白对基因调控的作用非常微弱[3]。没有组织蛋白,染色体中未缠绕的DNA将非常长(人类DNA中的长宽比超过1000万比1)。例如,每个人类二倍体细胞(含有23对染色体)具有约1.8米长的DNA,但是在组织蛋白上缠绕它具有大约90微米(0.09毫米)的染色质,当在有丝分裂期间复制和浓缩时,其导致约120微米的染色体[4]。
| 核心组蛋白H2A/H2B/H3/H4 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 PDB rendering of Complex between nucleosome core particle (h3,h4,h2a,h2b) and 146 bp long DNA fragment based on 1aoi. | |||||||||||
| 鉴定 | |||||||||||
| 标志 | Histone | ||||||||||
| Pfam | PF00125(旧版) | ||||||||||
| Pfam宗系 | CL0012(旧版) | ||||||||||
| InterPro | IPR007125 | ||||||||||
| SCOP | 1hio / SUPFAM | ||||||||||
| |||||||||||
分类和组蛋白变体
存在五个主要的组织蛋白家族: H1/H5,H2A,H2B,H3和H4[2][5][6][7] 。组织蛋白H2A,H2B,H3和H4被称为核心组织蛋白(Core Histone),而组织蛋白H1/H5被称为连接组织蛋白(Linker Histone)。
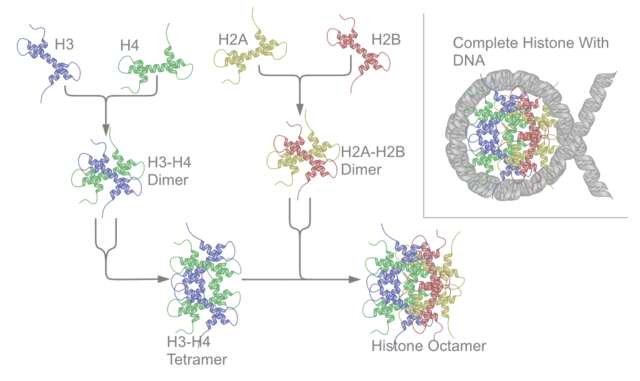
在H2A、H2B、H3及H4这四种组蛋白中的其中两种称为“核心组蛋白”,并且集合成为八聚体的核小体核心颗粒。这种集合是将DNA的146对碱基对以1.65左手超螺旋形围在这个蛋白质线轴。连接组蛋白H1将核小体核心颗粒与DNA的进入位点及E位点结合,因而可以将DNA紧扣在位,并且能容许形成更高层次的结构。最基本的形状为一个10纳米的纤维或一连串的珠子。这涉及将在每一个核小体之间约50对的DNA碱基对围在这些核小体上,这些DNA又称为连接DNA。较高层次的结构包括有30及100纳米的纤维,是在一般细胞内的结构。在减数分裂中,透过核小体与其他蛋白质的相互作用,合成染色体。合成的组蛋白与DNA称为染色质。
核心组蛋白是高度保守的蛋白质,意即组蛋白在氨基酸序列中有着非常小的改变。连接组蛋白通常有着多于一种的形状,对比核心组蛋白是保守程度较低的。
在主要的组蛋白类别中,亦存在一些异构体。它们有着相同的氨基酸序列及相似的核心结构,但却有着不同的特征。这些不同的组蛋白通常带着染色质的特别功能,就如与H3相似的CenpA是唯一的组蛋白与染色体的着丝点联合;H2A的异构体H2A.Z是与活性转录基因联合与涉及在异染色体的形成;另一个H2A异构体H2A.X以双链断裂与DNA结合,并进行DNA修复。
组蛋白H1有着一个中央球状结构域及长的C与N端尾巴,能将小珠子串结构围成30纳米大小的螺线管结构。对比其他种类的组蛋白,H1的数量只为其他的一半。这是因为它不是构成核小体部分,而只是将DNA及核小体紧扣在一起。H1亦有着它的异构体,称为组蛋白H5。
与组蛋白H2A及H2B类似,组蛋白H3有着一个主要的球状结构域与长的N端尾巴,是组成小珠子串结构内的核小体的重要原素。它的N端尾巴从球状核小体核心伸出,能进行多种影响细胞运作的表观遗传修饰。这些修饰包括将甲基及乙酰基共价附着于离氨酸或精氨酸,及丝氨酸或羟丁氨酸的磷酸化。离氨酸9的甲基化涉及基因沉默及在DNA内形成相对较不活跃的异染色质。组蛋白H3的乙酰基化会在组蛋白尾巴内不同的离氨酸位置出现,并且由组蛋白乙酰转移酶(HAT)所催化。离氨酸14的乙酰基化在基因中很普遍,亦会转录成为核糖核酸(RNA)。
以下是人类组蛋白的列表:
| 超级家族 | 家族 | 亚家族 | 成员 |
|---|---|---|---|
| 连接组织蛋白 | H1 | H1F | H1F0, H1FNT, H1FOO, H1FX |
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| 核心组织蛋白 | H2A | H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ |
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| H2A2 | HIST2H2AA3, HIST2H2AC | ||
| H2B | H2BF | H2BFM, H2BFS, H2BFWT | |
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| H2B2 | HIST2H2BE | ||
| H3 | H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | |
| H3A2 | HIST2H3C | ||
| H3A3 | HIST3H3 | ||
| H4 | H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | |
| H44 | HIST4H4 |
结构
核小体核心颗粒是由两个H2A-H2B二聚物及两个H3-H4二聚物结合而成,形成两半接近对称的蛋白质三级结构(2阶旋转对称,即1个高分子是另一个的镜像)。H2A-H2B及H3-H4二聚物本身亦呈现伪双向对称。
这四个核心组蛋白(H2A、H2B、H3及H4)是在结构上相似及在进化中高度保存的,所有均有着一个“螺旋缠绕螺旋缠绕螺旋”的形状,可以容许简单的二聚化。它们在氨基酸结构上都有着一条长的尾巴,让转录后修饰的进行。
总括来说,组蛋白与DNA有着五种的相互作用:
- H2B、H3及H4的α螺旋两极积聚正电,能与DNA的带有负电荷的磷酸盐分子团产生相互作用。
- 在DNA骨干与氨基之间的氢键对组蛋白的主链。
- 组蛋白与DNA的脱氧核糖的非极性相互作用。
- 碱性氨基酸(如离氨酸及精氨酸)旁链与DNA磷酸氧旁链之间的盐连及氢键。
- H3及H2B的N端尾巴的非特定副槽面插入至DNA分子的两个副槽面。
组蛋白最重要的基本性质,除了是协助与DNA的相互作用外,就是它的水溶性。
组蛋白的翻译后修饰会先在它的N端尾巴开始,再而在其球状结构域进行。这种修饰包括有甲基化、瓜氨酸化、乙酰化、磷酸化、小泛素相关修饰化、泛素化及二磷酸腺苷核糖基化。这些影响着组蛋白在基因调控的功能。
一般来说,活性的基因较少与组蛋白联系,但非活性的基因会在间期中与组蛋白联合。组蛋白的结构在进化上保存,这是因为任何有害的突变会造成严重的不适应性。
历史
于1884年,艾布瑞契·科塞尔首先发现组蛋白。直至1990年代早期,组蛋白才被更多认识,并非纯粹细胞核的惰性填充料,这部分基于马克·普塔什尼(Mark Ptashne)等人的模型,他们认为转录是被蛋白质-DNA和蛋白质-蛋白质相互作用在很大程度上被激活裸DNA模板,就像细菌一样。及后它的调控功能才被发现。
在1980年代,Yahli Lorch和罗杰·科恩伯格(Roger Kornberg)[8]表明,核心启动子上的核小体体外阻止了转录的启动,迈克尔·格伦斯坦(Michael Grunstein)[9]证明组蛋白在体内抑制转录,导致核小体为 一般基因阻遏物。
功能
组蛋白作为DNA缠绕的线轴。这使得能够在细胞核内将真核细胞的大型的基因组所必需的压实物:压实的分子比未压实的分子短40,000倍。
组织蛋白进行翻译后修饰,以更改它与DNA及其他核蛋白的相互作用。组织蛋白H3及H4有着核小体伸出的长尾巴,能够在不同的地方进行共价修饰。这种修饰包括有甲基化、瓜氨化、乙酰基化、磷酸化、小泛素相关修饰化、泛素化及二磷酸腺苷核糖基化。组织蛋白核心(即H2A及H3)亦可以作出修饰。修饰的组合可以组成编码,成为组织蛋白编码。组织蛋白修饰在不同的生物过程起着作用,包括基因表观调控、DNA修复、有丝分裂及减数分裂 [10]。
组织蛋白修饰的命名是:
举例来说,H3K4Me就代表组织蛋白H3从N端开始起计第4个赖氨酸的甲基化。
参考文献
参见
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

