热门问题
时间线
聊天
视角
离子晶体
来自维基百科,自由的百科全书
Remove ads


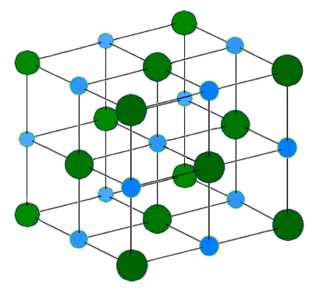
构成
离子晶体中含有电荷量相等的阴离子和阳离子,并且这两种离子交替排列,整齐有规律,往往呈现出规则的几何外形。比如:NaCl晶体呈现出立方体的空间构型,每个Na+周围有上下前后左右共6个最近的等距离的Cl−;每个Cl−周围有上下前后左右共6个最近的等距离的Na+;每个Na+周围有12个Na+;每个Cl−周围有12个Cl−。离子晶体中,离子与离子间不存在共价键(非分子化合物),所以,对于如氯化钠之类的离子晶体是不存在诸如“氯化钠分子”这个概念的。
计数
离子晶体的计量应区别于其他晶体。根据晶体中阴、阳离子的数目比,用实验式(注意不是分子式)表示该物质的组成。在一个氯化钠晶体中:
以下图中的晶体为例:
晶体的八个顶点顶点各有八分之一个氯离子,还有六个面每一个面都包进来了二分之一个氯离子,于是计算得Cl−的个数应该为:
个
晶体的十二条棱线分别占四分之一个钠离子,还有位于正方体体心有一个完整的钠离子,所以计算得Na+的个数为
个
注:人们所说的“1 mol NaCl”中的“NaCl”中含有1 mol Na+和 1 mol Cl−
计算得两种离子的个数比为所以,用化学式表示氯化钠的组成应为NaCl。这种方法叫“均摊法”,适用于计算离子晶体各种离子以及各种其他存在公用同一部分的情况的计算。[1]
Remove ads
特点
一般地,离子晶体的熔点、沸点都比较高(具体来说,分子晶体<离子晶体<原子晶体),硬度较大。离子晶体如NaCl在熔化状态下会电离出含有的阳离子和阴离子,携带相应的正负电荷,并且可以在水溶液中自由移动。[2]
概念交叉
需要提起读者注意的是,不要把离子化合物、离子晶体、含有离子键的物质等同起来。几者的概念有区别,其关系辨析如下:
参见
参考资料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads