热门问题
时间线
聊天
视角
硫的同素异形体
来自维基百科,自由的百科全书
Remove ads
硫有着大量的同素异形体,其数量只是仅次于碳。[1]除了有很多同素异形体,每个同素异形体通常还有各种同质异形体(相同结构的硫分子的不同晶体结构),由希腊字母前缀(α、β 等)区分。[2]
此条目需要扩充。 (2012年11月30日) |

此外,由于硫元素几个世纪以来一直都是一件商品,它的各种同素异形体都被赋予了传统名称。早期的工人发现了一些后来被证明是硫的单一或混合的同素异形体。某些形式以其外观命名,例如 “珍珠硫之母”,或者以在鉴定它们的方面非常杰出的化学家命名,例如 “Muthmann硫I”或“Engel硫”。[2][3]
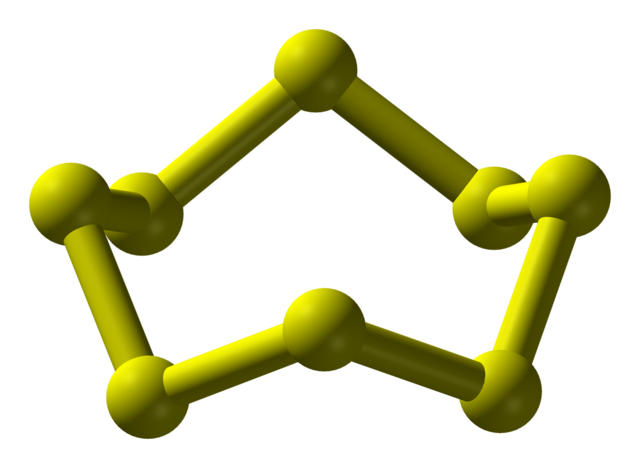
最常见的硫形式是 S
8 的正交晶系同质异形体,为褶皱环结构(见右图)。S8还有另外两种同质异形体,也具有几乎相同的分子结构。[4]除了 S8,以外,含有 6、7、9–15、18 和20个原子的硫环也是已知的。[5] 在五种高压同素异形体中,有两种有金属性。[6]
硫的同素异形体的数量反映了相对较强的S-S键,键能 265 kJ/mol。[7]此外,与大多数元素不同,硫的同素异形体可以在有机溶剂中进行处理,并且可以通过HPLC进行分析。[8]
Remove ads
气态同素异形体
二硫为硫的双原子分子。在720°C,硫主要以二硫存在。在530°C、低压(1毫米水银)的环境中,硫蒸气占99%是二硫。火焰中产生的S2分子使硫燃烧时呈蓝色。[1]
在硫蒸汽存在。根据理论计算的最新观点认为四硫有着环状结构。[9]
尚未分离,只在硫蒸汽侦测到。[10]
固体环状结构
S6的晶形为菱面体,为橙红色固体,首次透过下列反应发现于1891年。
这是由含S6和S10的二硫化碳中之溶液制备所得。
为亮黄色固体,有α、β、γ、δ四种结构。环七硫的环有着不寻常幅度的键长(199.3–218.1 pm),因此被认为是最不稳定的同素异形体。

α-硫是硫自然界中最常见的形式,[1]其纯净时的颜色是黄绿色(市面上出售的硫因为有着微量的环七硫而呈现更黄的颜色)。α-硫实际上不溶于水,导热性能差,为一良好的电绝缘体。此是硫由二硫化碳结晶而得之紧密的黄色晶体,熔点112.8度。
融化硫于部分凝固后,倒出多余液体,剩下无数之针形晶体即为单斜硫,融点119.2度。
为沸腾之硫注入冷水所得之软黏体,有弹性。
发现于1890年,为融化硫由二硫化碳缓慢结晶而成。

这些同素异形体是由多种方法合成,例如 可以透过二氯化硫(Sn-mCl2)和H2Sm反应,即
Sn−mCl2 + H2Sm → cyclo-Sn+2 HCl[1]
制取。S12、S18、S20可以由S8制得,其中S12是继S8后最稳定的环状同素异形体。S9有4种形式,S18则有2种。
固体连锁硫结构
生产纯净的连锁硫已被证明是极其困难的。
亦称“纤维硫”或ω1-硫[10],其密度为2.01 g·cm−3,会在其融点104°C附近分解。
亦称ω2-硫。
连续硫形式
这是硫在160°C以上时融解的淬火产物。
此为融化后熔融的硫的名字,冷却此主要给出β-硫。[10]
把硫加热至170°C可形成S∞。
参考资料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
