氧化镓
化合物 来自维基百科,自由的百科全书
氧化镓是镓最稳定的氧化物,化学式为Ga2O3,是一种无机化合物,白色的晶体粉末,具有两性。它是作为制造宽带隙半导体的一部分。
| 氧化镓 | |
|---|---|
| |

| |
| 别名 | 氧化镓(III) 三氧化二镓 |
| 识别 | |
| CAS号 | 12024-21-4 |
| PubChem | 5139834 |
| ChemSpider | 4313617 |
| SMILES |
|
| InChI |
|
| InChIKey | QZQVBEXLDFYHSR-OGCFUIRMAC |
| RTECS | LW9650000 |
| 性质 | |
| 化学式 | Ga2O3 |
| 摩尔质量 | 187.444 g·mol⁻¹ |
| 外观 | 白色晶体粉末 |
| 密度 | 6.44 g/cm3(α) 5.88 g/cm3(β) |
| 熔点 | 1900 °C(2173 K) |
| 溶解性(水) | 难溶 |
| 溶解性 | 可溶于酸和碱金属氢氧化物溶液 |
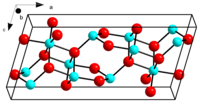
| 结构[1][2] | |
| 晶体结构 | 单斜晶系,mS20 |
| 空间群 | C2/m(No. 12) |
| 晶格常数 | a = 1.2232 nm, b = 0.3041 nm, c = 0.5801 nm |
| 晶格常数 | α = 90°, β = 103.73°, γ = 90° |
| 热力学[3] | |
| ΔfHm⦵298K | −1089.1 kJ/mol |
| S⦵298K | 85.0 J/(mol·K) |
| 热容 | 92.1 J/(mol·K) |
| ΔfH⦵fus | 100 kJ/mol |
| 危险性 | |
| 欧盟分类 | 未列出 |
| 相关物质 | |
| 其他阴离子 | 硫化镓 硒化镓 碲化镓 |
| 其他阳离子 | 氧化硼 氧化铝 氧化铟 氧化铊 |
| 相关化学品 | 氧化亚镓 氢氧化镓 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
氧化镓可以通过在空气中加热金属镓或在200~250℃热分解硝酸镓得到。氧化镓有五种形态——α, β, γ, δ和ε,其中β-Ga2O3是最稳定的形态。[4]
- 2 C + Ga2O3 → Ga2O + 2 CO
- Ga2O3 + 3 C → 2 Ga + 3 CO
- 2 Ga2O + 2 O2 → 2 Ga2O3
- 4 Ga + 3 O2 → 2 Ga2O3
化学性质
氧化镓可以和碱金属氧化物在高温反应,产生偏镓酸盐,如NaGaO2;和Mg、Zn、Co、Ni、Cu的氧化物加热形成尖晶石型晶体,如MgGa2O4。[7]
它溶于碱金属氢氧化物溶液,形成Ga(OH)−
4羟基配离子。
它和氯化氢气体在氩气气氛中反应,生成无水三氯化镓GaCl3:[8]
- Ga2O3 + 6 HCl → 2 GaCl3 + 3 H2O
和氟气反应,产生无水氟化镓;溶于50%氢氟酸,生成氟化镓的三水合物:[9]
- Ga2O3 + 6 HF → 2 GaF3·3H2O
它可以被氢气还原为氧化亚镓(一氧化镓)Ga2O,[10]也可以被单质镓还原:[11]
- Ga2O3 + 2 H2 → Ga2O + 2 H2O
- Ga2O3 + 4 Ga → 3 Ga2O
应用
氧化镓是一种重要的功能性材料。人们正在研究将它们用于激光、萤光粉和发光材料,并且已证明它们具有催化特性,可作为半导体结中的绝缘屏障。[12]。
稳定的氧化物单斜晶系β-氧化镓(III)用于气体传感器、萤光粉、发光材料和太阳能电池的电介质涂层。透明导体在深紫外线领域的应用潜力也已被证实。[13]
参看
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
