热门问题
时间线
聊天
视角
肌動蛋白
来自维基百科,自由的百科全书
Remove ads
肌動蛋白(英語:Actin)是一類分子量大約在42,000的球狀蛋白質。除了已經知道的線蟲類精子細胞之外,在所有的真核細胞當中均發現有該蛋白質,濃度約在100μM以上,其質量約為42kDa,直徑為4至7nm。
肌動蛋白是生物體中微絲的兩個單體亞基之一,而微絲則是細胞骨架三大組成結構之一,肌動蛋白還構成了肌細胞中具有收縮功能的組織。所以,肌動蛋白對於細胞活動起到很大的作用,比如肌肉的收縮,細胞的轉移、分裂和原質的流動、囊泡和胞器的運動、細胞間信息的傳遞、細胞的形狀和連結的建立和維持等等。
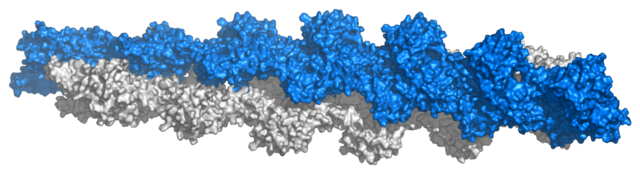
肌動蛋白可以作為稱為G-肌動蛋白 (球狀)的游離單體存在,或作為稱為F-肌動蛋白(絲狀)的線性聚合物微絲的一部分存在,這兩者對於細胞的移動和收縮等重要的細胞功能是必不可少的。
有許多疾病是由調控肌動蛋白基因表達活性的蛋白及其相關蛋白的等位基因突變引起的。肌動蛋白基因表達也是一些病原微生物感染過程中的關鍵因素。一些肌動蛋白調孔蛋白的突變會導致肌肉性肌病,包括心臟大小與功能的變化以及耳聾等。細胞骨架的組裝也與細胞內細菌與病毒的致病性有關,特別是在逃避免疫系統作用有關的過程中[2]。
Remove ads
發現和早期調查

肌動蛋白首先在1887年由威廉·哈里伯頓(W.D. Halliburton)實驗觀察,他從肌肉中提取了一種「凝固」肌凝蛋白製劑的蛋白質,他稱之為「肌凝蛋白-酵素」[3]。然而,哈里伯頓無法進一步完善他的研究結果,而肌動蛋白的發現則歸功於施特勞烏布·費倫茨·布魯諾(Brunó Ferenc Straub),他是一名年輕的生物化學家,在匈牙利的塞格德大學醫學化學研究所的阿爾伯特·聖捷爾吉(Albert Szent-Györgyi)實驗室工作。
1942年,施特勞烏布開發出一種新技術,用於提取肌肉蛋白,使其能夠分離出大量相對純淨的肌動蛋白。 施特勞烏布的方法與今天的實驗室使用的方法基本相同。 阿爾伯特·聖捷爾吉之前曾將慢肌提取產生的更為粘稠的肌球蛋白描述為「激活的」肌球蛋白,並且由於施特勞烏布的蛋白質產生了激活作用,因此它被稱為肌動蛋白。將三磷酸腺苷(ATP)添加到兩種蛋白質的混合物(稱為肌動蛋白)中會導致粘度降低。
第二次世界大戰的敵對行動意味着阿爾伯特·聖捷爾吉和施特勞烏布無法在西方科學期刊上發表這些作品。因此,肌動蛋白在1945年才在西方成名,當時他們的論文作為"Scandavica Acta Physiologica"期刊的補充出版[4]。 施特勞烏布繼續研究肌動蛋白,並在1950年報道肌動蛋白含有結合的三磷酸腺苷(ATP) [5],並且在蛋白質聚合成微絲的過程中,核苷酸被水解成二磷酸腺苷(ADP)和無機磷酸鹽(其仍然與微絲結合)。 施特勞烏布認為ATP結合肌動蛋白向ADP結合肌動蛋白的轉化在肌肉收縮中發揮作用。事實上,這隻適用於平滑肌,直到2001年才通過實驗得到支持[5][6]。
肌動蛋白的氨基酸測序由M. Elzinga及其同事於1973年完成[7]。 G-actin的晶體結構由Kabsch及其同事在1990年解決[8]。在同一年,Holmes及其同事在使用與不同蛋白質共結晶的實驗後提出了F-肌動蛋白的模型[9]。在接下來的幾年中,重複使用與不同蛋白質共結晶的程序,直到2001年,分離的蛋白質與ADP一起結晶。然而,仍然沒有F-肌動蛋白的高解像度X射線結構。由於使用通過阻斷半胱氨酸cys-374阻礙聚合的羅丹明結合物,F-肌動蛋白的結晶是可能的[1]。 Christine Oriol-Audit在肌動蛋白首次結晶的同一年去世,但她是1977年在沒有肌動蛋白結合蛋白(ABPs)的情況下首次結晶肌動蛋白的研究員。然而,由此產生的晶體對於當時可用的技術來說太小了[10]。
儘管目前還沒有肌動蛋白絲狀形式的高解像度模型,但是在2008年,Sawaya的團隊能夠基於多種肌動蛋白二聚體晶體在不同的地方產生更精確的結構模型[11]。 此模型隨後由Sawaya和Lorenz進一步完善。 其他方法,例如使用低溫電子顯微鏡和同步輻射,最近允許提高解像度和更好地理解與肌動蛋白絲形成有關的相互作用和構象變化的性質[12][13][14]。
Remove ads
結構和分類
在生物分子演化當中,肌動蛋白是高度保守的蛋白質分子之一,從藻類到人類細胞肌動蛋白只有不到20%的變化。[15][16]因此,它被認為具有優化的結構[15]。 它有兩個顯着特徵:它是一種能夠緩慢水解ATP的酶,這是生物過程的「通用能量貨幣」。 但是,ATP是必需的,以保持其結構完整性。 其高效的結構由幾乎獨特的摺疊過程形成。此外,它能夠比任何其他蛋白質進行更多的相互作用,這使得它在幾乎所有細胞生命水平上都能比其他蛋白質發揮更廣泛的功能[15]。 肌凝蛋白是與肌動蛋白結合的蛋白質的一個例子。 另一個例子是絨毛蛋白,它可以根據周圍培養基中鈣陽離子的濃度將肌動蛋白編織成束或切割長絲[17]。
肌動蛋白是在真核生物中最豐富的蛋白質之一,在整個細胞質中都可以找到它[17]。 事實上,在肌肉纖維中,它占細胞總蛋白質的20%,在其他細胞中佔1%-5%。然而,不僅有一種肌動蛋白,編碼肌動蛋白的基因被定義為基因家族(植物中含有超過60種元素的家族,包括基因和假基因,在人類中超過30種元素)[15][18]。這意味着每個個體的遺傳信息包含產生具有略微不同功能的肌動蛋白的變體(稱為同種型)的指令。 反過來,這意味着真核生物表現不同的基因,這些基因產生:α-肌動蛋白,存在於收縮結構中; β-肌動蛋白,發現於細胞的擴展邊緣,使用其細胞結構的投射作為其移動手段; 和γ-肌動蛋白,存在於應力纖維的細絲中[19]。除了生物體異構體之間存在的相似性之外,甚至在不同真核生物結構域中包含的生物之間也存在結構和功能的進化保守性:在細菌中已經鑑定了肌動蛋白同源物MreB,其是能夠聚合的蛋白質[13][15]。 和古菌中的同源物Ta0583甚至更類似於真核生物的肌動蛋白[20]。
Remove ads
參見
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

