絕熱過程
概念 来自维基百科,自由的百科全书
絕熱過程(英語:adiabatic process)是一個絕熱體系的變化過程,絕熱體系為和外界沒有熱量和粒子交換,但有其他形式的能量交換的體系,屬於封閉體系的一種。絕熱過程有絕熱壓縮和絕熱膨脹兩種。常見的一個絕熱過程的例子是絕熱火焰溫度,該溫度是指在假定火焰燃燒時沒有傳遞熱量給外界的情況下所可能達到的溫度。現實中,不存在真正意義上符合定義的絕熱過程,絕熱過程只是一種近似,所以有時也稱為絕熱近似。
絕熱過程分為可逆過程(熵增為零)和不可逆過程(熵增不為零)兩種。可逆的絕熱過程是等熵過程。等熵過程的對立面是等溫過程,在等溫過程中,最大限度的熱量被轉移到了外界,使得系統溫度恆定如常。由於在熱力學中,溫度與熵是一組共軛變量,等溫過程和等熵過程也可以視為「共軛」的一對過程。
如果一個熱力學系統的變化快到足以忽略與外界的熱交換的話,這一變化過程就可以視為絕熱過程,又稱「準靜態過程」。準靜態過程的熵增可以忽略,所以視作可逆過程,嚴格說來,在熱力學中,準靜態過程與可逆過程沒有嚴格區分,在某些文獻中被作為同義詞使用。
同樣的,如果一個熱力學系統的變化慢到足以靠與外界的熱交換來保持恆溫的話,該過程則可以視為等溫過程。
絕熱壓縮與絕熱膨脹
絕熱壓縮與絕熱膨脹通常由氣體壓強的變化引起。
絕熱壓縮發生在氣壓上升時,這時氣體溫度也會上升。例如,給自行車打氣時,可以感覺到氣筒溫度上升,這是因為氣體將壓縮其所作的功轉換成自身的內能,因而溫度上升。柴油機在壓縮衝程時正是靠絕熱壓縮原理來給燃燒室內的混合氣體點火的。
絕熱膨脹發生在氣壓下降時,這時氣體溫度也會下降。例如,給輪胎放氣時,可以明顯感覺到放出的氣體比較涼,這是因為氣體從輪胎的充氣孔出來時,先被小洞壓縮後瞬間膨脹的緣故,氣體為了膨脹,因此將周遭空氣「撐開」,過程中需要作功,消耗了自身內能,使溫度下降。
這些溫度的變化量可以用理想氣體狀態方程式精確計算。
用理想氣體狀態方程式求解絕熱過程
對於經典氣體(非費米氣體、玻色氣體)的方程式如下,是一個多方方程式:
- 常數
其中:
對於絕熱過程有:
其中C為常數。
絕熱過程的熱力學第一定律具體形式如下:
因為絕熱過程沒有熱交換,所以,由熱力學第一定律,有
dU為系統內能的變化量;δW是系統所作的功,作功必須耗費內能。由於δQ為零,可以得到
- 。
理想氣體的內能可以由如下式子得到:
R為理想氣體常數;n為系統粒子的物質的量(因為絕熱過程無粒子交換,所以恆定不變);。
對(3)式兩邊微分,代入理想氣體狀態方程式得到
- 。
因為,(4)式通常寫作
將(2,3,4)代入到(1),有:
簡化得到:
兩邊同除以PV
- 。
分別對P、V積分,得到
- 。
兩邊分別取冪:
消去負號:
- 。
因此得到:
和
Const為常數。
從狀態1到狀態2,系統的內能變化為:
同時,氣體作功為:
因為絕熱,所以有:
將(1,2)式分別帶入得到:
或:
因為實際情形下,通常可以假定氣體質量數不變,該式可以簡化為:
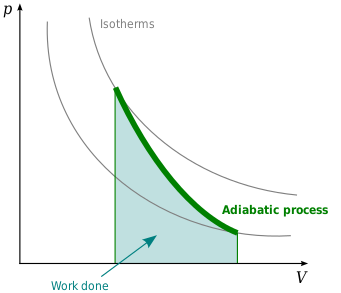
等熵線圖

等熵線又稱絕熱線,是指P-V圖中等熵的一條曲線,如右圖黑色線條所示。等熵線有以下性質:
- 像等溫線一樣對稱的趨近V軸與P軸。
- 每條等熵線只穿過同一條等溫線一次。
- 等熵線與等溫線相似,但斜率更大。
- 若等溫線凹向45度方向處,則等熵線凹向31度方向處。
- P-V圖上一系列的等溫—等熵線所繪出的眼形方塊顯示出向原點方向移動的趨勢。參見能斯特定理。
右圖是絕熱線和等溫線疊加的一個P-V圖。
參見
參考文獻
- 汪志誠. 《热力学与统计物理(第三版)》. 高等教育出版社. 2003年3月.
- 吳大猷. 《热力学、气体运动论及统计物理》. 科學出版社. 1983年7月.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


































