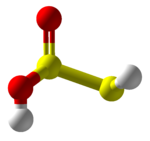
硫代亞硫酸(HS−S(=O)−OH)是一種硫的含氧酸,擁有低氧化態 (+1) 的硫。[3]它可以被視為一氧化二硫的對應酸。 硫代亞硫酸可以由在室溫下反應硫化氫和二氧化硫而成。[4]硫代亞硫酸分子縮合時不穩定,會與其自身反應。 [5]
| 硫代亞硫酸 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 sulfurothious S-acid[1] sulfurothious O,S-acid[2] | |||
| 系統名 hydroxidooxidosulfanidosulfur[1] | |||
| 別名 | sulfurothionous acid | ||
| 識別 | |||
| CAS號 | 15060-43-2 | ||
| PubChem | 9548652 | ||
| ChemSpider | 7827575 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QAMMXRHDATVZSO-UHFFFAOYSA-N | ||
| Gmelin | 184467 | ||
| ChEBI | 35926 | ||
| 性質 | |||
| 化學式 | HS-S(=O)-OH | ||
| 摩爾質量 | 98.14668 g·mol⁻¹ | ||
| 相關物質 | |||
| 相關化學品 | 硫代硫酸 SSO 硫代次硫酸 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
其它硫代亞硫酸的可能異構體有連二次硫酸,結構式 HOSSOH,是一種鏈狀分子;硫化次硫酸 (S=S(OH)2) ,是硫代亞硫酸的互變異構體,由巰基中的氫原子移動到氧原子那裏去而成。[6]HOSSOH 有兩種構象異構,對稱性分別為 C1 和 C2。根據計算,硫代亞硫酸本身是最穩定的異構體。[7]
反應
硫代亞硫酸可以由二氯化二硫的水解而成。
在鹼性條件下,硫代亞硫酸會迅速分解,形成硫化物,硫,亞硫酸鹽和硫代硫酸鹽的混合物。在酸性條件下,它也會分解並形成硫化氫和二氧化硫。當中的一些反應會形成連五硫酸酯和其他聚硫酸酯。硫代亞硫酸與亞硫酸反應生成連四硫酸酯,並與硫代硫酸生成連六硫酸酯。[8]
鹽
硫代亞硫酸的鹽被稱為硫代亞硫酸鹽。這個陰離子為S=SO2−
2[來源請求]。不過,它們都未被發現。
酯
對於 R2S2O2,有四種可能的異構體。它們可能有二價和四價硫:(RO)2S=S、ROSSOR、RS(O)2SR和RS(O)SOR。對於前兩個硫代亞硫酸酯,R基團是等價的,不過後兩個的R基團不是等價的。一個簡單的硫代亞硫酸酯是硫代亞硫酸乙酯 (EtO)2S=S。它也被稱為二乙基硫代亞硫酸。它在NMR時標上為約140℃的立體化學剛性,有點類似於二乙基亞碸。許多衍生物是由二醇製備的。從間-二苯乙二醇 (PhCH(OH)−CH(OH)Ph)中,可以得到兩種異構體,而第三個異構體來自 d,l-PhCH(OH)−CH(OH)Ph。[9][10]
簡單烷氧基的來源和二氯化二硫的反應形成沒有支鏈的ROSSOR。它們與水不混溶,但溶於苯或四氯化碳。[8]這些物質的硬性不如硫代亞硫酸酯。
參考資料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.