標準氫電極
来自维基百科,自由的百科全书
標準氫電極(英文:Standard Hydrogen Electrode,舊時用Normal Hydrogen Electrode,簡稱NHE,現已停用),簡稱SHE,是構成標準電極電勢()基準的工作電極。在25℃時,它的絕對電位大約為4.44±0.02V,但為了給所有電極反應的電動勢設立一個基準值,在任意溫度下氫電極的標準電極電勢都定義為零[1]。其他電極的電勢都是相對於標準氫電極而確定的。
氫電極的氧化還原半反應式如下:
- 2H+(aq) + 2e- → H2(g)
這個半反應是在鍍有鉑黑的處於標準狀態(氣體壓強為1大氣壓、離子或分子的濃度為1mol/L的溶液)的鉑電極上發生的,相應的能斯特方程為:
或
其中:
一般氫電極(NHE)與標準氫電極(SHE)之間的區別
在電化學發展的早期,研究人員曾使用一般氫電極作為零電位。這種電極的定義是「鉑電極浸在濃度為1N的一元強酸中,放出壓力約1atm的氫氣」。可見它能夠實際實現,因而使用很方便。然而,這樣的電極-溶液界面並不完全可逆,所以後來零電位的定義有所改變——新的定義是一個氫離子的活度為1mol/L的理想電極-溶液界面(即假設氫離子與其他微粒沒有任何相互作用,顯然現實中無法實現)。為了便於區分,這個新標準稱為「標準氫電極」。[2]
總之,
- 一般氫電極(Normal Hydrogen Electrode,NHE):鉑電極在1N的強酸溶液中所構成的電極(歷史標準,現已棄用)。
- 標準氫電極(Standard Hydrogen Electrode,SHE):鉑電極在氫離子活度為1mol/L的理想溶液中所構成的電極(當前零電位的標準)。
鉑的選擇
在選擇用於標準氫電極的鉑時,應考慮如下幾個因素:
- 鉑的活潑程度(越不活潑自然越不會被腐蝕);
- 催化氫氣變為氫離子的反應的性能;
- 鉑固有的交換電流密度高低;
- 可逆性的高低(兩個完好的標準氫電極的電勢相差不超過10μV)[3];
- 鉑表面是否有被鍍過(如鍍一層鉑黑)。這是為了:
- 增大總的表面積。這會增大了反應的性能,加快反應速率。
- 更好地吸附氫氣到表面上,同樣能夠加快反應速率。
其他的金屬也能用作電極並起到相似的作用,例如鈀。
干擾
由於鉑電極有極高的吸附性,避免電極與溶液和有機物或是大氣中的氧氣接觸是很重要的。有氧化性的無機物(如Fe3+、CrO42-等)同樣也要與電極隔離。
同位素效應
氘的電極反應方程式如下:
- 2D+(aq) + 2e- → D2(g)
電極電勢的測量
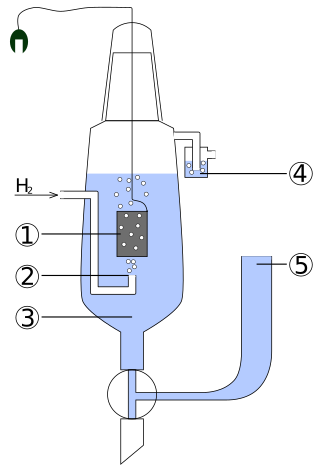
圖中裝置用於測量某一工作電極的電極電勢。其中各數字代表含義如下:
- 鉑黑電極。
- 氫氣於此處噴出。
- H+活度為1mol/L的酸溶液。
- 水封,防止氧氣干擾實驗。
- 連接到另一工作電極。可以直接連通,也可以使用鹽橋,選擇何者取決於另一電極的電解液。若減小管徑,可以減小混合的程度。
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





