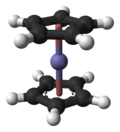
二茂鐵(英文:Ferrocene,簡寫Fc),或稱環戊二烯基鐵,是分子式為Fe(C5H5)2的有機金屬化合物,在室溫會微量昇華而帶有似樟腦的特殊氣味。二茂鐵是最重要的金屬茂基配合物,也是最早發現的夾心配合物[1],包含兩顆環戊二烯負離子以π電子與鐵原子成鍵。
| 二茂鐵 | |||
|---|---|---|---|
| |||

| |||

| |||
| IUPAC名 bis(η5-cyclopentadienyl)iron(II) | |||
| 別名 | 雙環戊二烯基合鐵(II)、環戊二烯基鐵、環戊二烯鐵 | ||
| 識別 | |||
| CAS號 | 102-54-5 | ||
| PubChem | 11985121 | ||
| ChemSpider | 7329 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | KTWOOEGAPBSYNW-UHFFFAOYAZ | ||
| ChEBI | 30672 | ||
| 性質 | |||
| 化學式 | C10H10Fe | ||
| 摩爾質量 | 186.04 g·mol⁻¹ | ||
| 外觀 | 橘黃色固體 | ||
| 密度 | (20°C) 2.69 g/cm³ | ||
| 熔點 | 174 °C | ||
| 沸點 | 249 °C | ||
| 溶解性(水) | 不可溶 | ||
| 溶解性(大多數有機溶劑) | 可溶 | ||
| 危險性 | |||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化學品 | 二茂鈷、二茂鎳 二茂鉻、二苯鉻 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
製備
二茂鐵可用很多方法製備,常用的包括令環戊二烯基鈉與氯化亞鐵在四氫呋喃中反應:
- FeCl2+2NaC5H5 → 2NaCl+Fe(C5H5)2
另一種方法是氯化亞鐵與環戊二烯在三乙胺、二乙胺等鹼溶液反應:
- FeCl2+2C5H6+2Et3N → Fe(C5H5)2+Et3NHCl
歷史


二茂鐵的發現純屬偶然。1951年,杜肯大學的Pauson和Kealy用環戊二烯基溴化鎂處理氯化鐵,試圖得到二烯氧化偶聯的產物富瓦烯(Fulvalene,如圖),但卻意外得到了很穩定的橙黃色固體。[2]當時他們認為二茂鐵的結構並非夾心,而是如右圖所示,並把其穩定歸因於芳香的環戊二烯基負離子。與此同時,Miller、Tebboth和Tremaine在將環戊二烯與氮氣混合氣通過一種還原鐵催化劑時也得到該橙黃色固體。[3]
羅伯特·伯恩斯·伍德沃德和傑弗里·威爾金森,[4]及恩斯特·奧托·菲舍爾[5]分別獨自發現了二茂鐵的夾心結構,且後者還在此基礎上開始合成二茂鎳和二茂鈷。NMR光譜和X射線晶體學的結果也證實了二茂鐵的夾心結構。[6][7]二茂鐵的發現展開了環戊二烯基與過渡金屬的眾多π配合物的化學,也為有機金屬化學掀開新帷幕。
1973年慕尼黑大學的恩斯特·奧托·菲舍爾及倫敦帝國學院的傑弗里·威爾金森爵士獲授諾貝爾化學獎,以表彰他們在有機金屬化學領域的傑出貢獻。
電子結構
穆斯堡爾譜學數據顯示,二茂鐵中心鐵原子氧化態為+2,每個茂環有一單位負電荷。每個環有6顆π電子,符合休克爾規則中4n+2電子數的要求(n為非負整數),每個環都芳香。每個環的6顆電子*2,再加上二價鐵離子的6顆d電子正好等於18,符合18電子規則,非常穩定。
二茂鐵兩個茂環可以是重疊(D5h),也可以是錯位(D5d),兩者間的能壘僅有每摩8至20kJ。重疊構型可能較穩定,但在晶體中分子間作用能在數量級上與能壘差不多大或略大些,所以各種各樣的構型都可存在。[8]
物理性質
二茂鐵是對空氣穩定的橙黃色固體,在真空和加熱時迅速升華。和其他對稱且不含電荷的物質類似,二茂鐵可溶於苯等大多數有機溶劑,但不溶於水。
二茂鐵在100°C時顯著升華。下表列出一些重要的蒸氣壓數據及相應溫度值:[9]
| 蒸氣壓(Pa) | 1 | 10 | 100 |
|---|---|---|---|
| 溫度(K) | 298 | 323 | 353 |
化學性質
二茂鐵有芳香化合物的顯著特徵,可與親電試劑反應生成二茂鐵的取代衍生物。大多數取代的類型是1-取代物、1,1'-二取代物及1,2-二取代物(帶「'」表示在A環上,不帶則表示在B環上)。如二茂鐵與三氯化鋁和Me2NPCl2在熱庚烷中反應生成二氯二茂鐵膦(Dichloroferrocenyl phosphine),[10]當與苯基二氯化膦在類似條件下反應得到P,P-二氯雙(二茂鐵)-P-苯基膦。[11]與苯甲醚類似,二茂鐵與P4S10反應生成Dithiadiphosphetane disulfide。[12]二茂鐵不可以直接硝化和鹵化,因為會先氧化(參見#氧化還原反應)。
二茂鐵可起傅-克反應,如有磷酸催化時,二茂鐵與乙酸酐或乙酰氯反應生成乙酰基二茂鐵。

雖然一方面二茂鐵許多反應類似於芳香烴的相應反應,但另一方面有些反應明顯是鐵原子在起主要作用,[8]如在親電取代反應中,親電試劑看上去是先進攻鐵原子:

用丁基鋰可很快奪取二茂鐵的質子,產物為1,1'-二鋰代二茂鐵,是很強的親核試劑。它與二乙基二硫代氨基甲酸硒反應,生成的產物有位阻,兩顆環戊二烯基配體靠硒原子連接。[13]該產物可藉加熱開環聚合反應(ROP)生成聚硒化二茂鐵(Poly(ferrocenyl selenide)),矽和磷的類似反應也可合成相應聚合物Poly(ferrocenylsilane)和Poly(ferrocenylphosphine)。[14][15]

二茂鐵在酸性溶液很易氧化為藍色順磁性的二茂鐵鎓離子[(η5-C5H5)2FeIII]+,其電勢以飽和甘汞電極為標準大約為0.5V。產物二茂鐵不太活潑且易於分離,該離子有時用作氧化劑,以六氟磷酸鹽[PF6]−或氟硼酸鹽[BF4]−的形式存在。[16]環上不同的取代基會改變該電勢值:吸電子基(如羧基)提升電極電勢值;而給電子基(如甲基)則降低該值,氧化變易。全甲基二茂鐵氧化後生成的鹽[Fe(η5-C5Me5)2][tcne](tcne為四氰乙烯)有不尋常的磁性,[17]為深綠色晶體,有陽離子與陰離子交替出現的長鏈。
二茂釕和鋨的類似陽離子[MIII(η5-C5H5)2]+卻不穩定,易繼續氧化為[MIV(η-C5H5)2]2+陽離子或二聚成為[(η5-C5H5)2MIII-MIII(η5-C5H5)2]2+。[18]
二茂鐵及衍生物的應用
二茂鐵自身的應用並不多,但用已知的方法可以合成出種類繁多的衍生物,大大延伸了二茂鐵的應用範圍。
二茂鐵及其衍生物是汽油中的抗震劑,它們比曾經使用過的四乙基鉛安全得多。[19]在英國的哈爾福斯Halfords可以買到含二茂鐵的汽油添加劑,它尤其適用於以前專為四乙基鉛抗震劑設計的車輛。[20]二茂鐵分解出的鐵沉積在火花塞表面,使其更導熱。
添加二茂鐵同樣也可以減少柴油車冒出的煤煙。
某些二茂鐵的鹽類有抗癌活性,如他莫昔芬的二茂鐵同類物,[21]其機理為,他莫昔芬可以與雌激素結合,其細胞毒性可以殺死癌細胞。[22][23][24]
衍生物

五羰基鐵與環戊二烯在高壓釜中於135°C反應得到深紅紫色晶體的雙核絡合物環戊二烯基羰基鐵[Fe(η5-C5H5)(CO)2]2,它對空氣和水都穩定。結構測定表明該化合物中兩組成橋羰基及兩塊鐵原子共平面,且有鐵-鐵鍵。環戊二烯基羰基鐵很易製備,且在有機合成中有廣泛應用。[8]
參考資料及註釋
延伸閱讀
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.