超共軛效應
来自维基百科,自由的百科全书
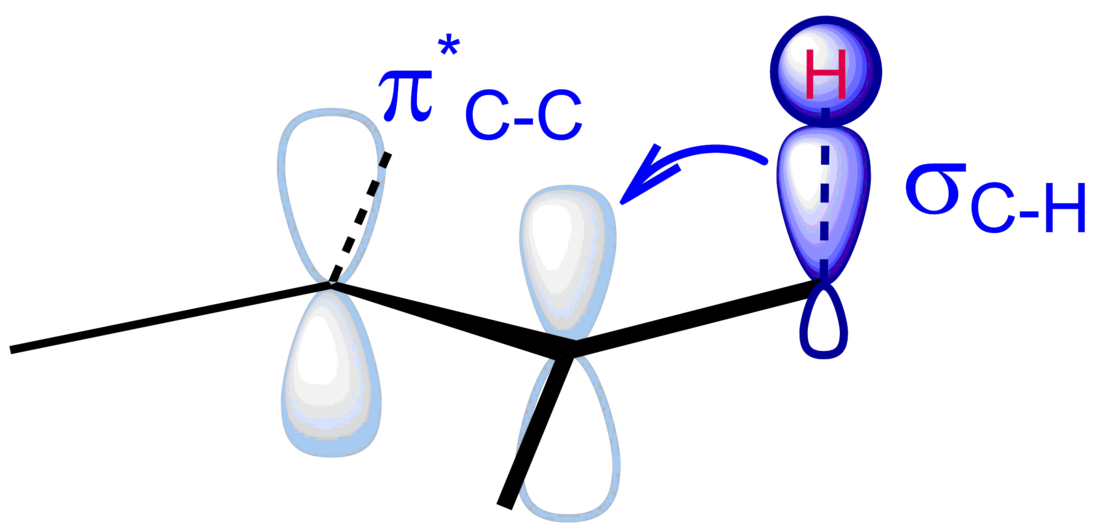
超共軛效應(英語:hyperconjugation,亦稱σ-共軛或非鍵共振[1])在有機化學中用來描述一個σ鍵裏的電子(通常是C-H鍵)與相鄰未填滿的非鍵P軌道或反鍵π*軌道(或σ*軌道)間發生的相互作用,該相互作用能夠使整個體系變得更穩定,這是由於該作用能夠生成一個較大的分子軌道。[2]對於一個碳陽離子來說,只有位於正電荷β位的鍵上的電子能夠通過超共軛來穩定整個碳正離子。

歷史
1939年,羅伯特·S·馬利肯在他關於紫外光譜和共軛分子的研究中首次提出超共軛概念。[3] 他觀察到隨着烯上的烷烴增多,吸收光譜移向長波長端,即紅移,他也首次提出造成取代烯烴的氫化熱較低的原因是超共軛效應。在超共軛這個概念提出之前,人們已經在1935年提出了貝克-內森效應,並嘗試用共軛效應來解釋這一現象[4][5]。
應用
超共軛也可以解釋很多其他的化學現象,例如端基異構效應、偏轉效應、β-矽基效應、環外羰基的振動頻率以及取代碳正離子的穩定性等。根據量子力學模型的推導,交叉式構象的優先性也可以由超共軛效應來解釋,而不是老的教科書提到的位阻效應。[6][7]
超共軛效應能影響分子的結構與化學性質,主要體現在:[8][9]
- 鍵長:超共軛效應使σ鍵鍵長變短。例如,1,3-丁二烯與丙炔中C–C單鍵鍵長均為1.46Å,小於一般的C-C單鍵鍵長。對於1,3-丁二烯,可由電子離域解釋,而丙炔無交叉的C-C雙鍵,沒有離域大π鍵,其C–C單鍵鍵長小於一般值是炔基的π鍵與甲基C-H鍵的σ-π超共軛導致的。
- 偶極矩:1,1,1-三氯乙烷相比氯仿偶極矩大得多,這可能是氯仿中氯的p軌道與C-H鍵之間的超共軛減小了電子偏向氯的程度的緣故。
- 生成熱:有超共軛效應的分子,生成熱大於鍵能的總和;丙烯的氫化熱小於乙烯,1-丁烯氫化熱大於丙烯。
- 碳正離子的穩定性:(CH3)3C+ > (CH3)2CH+ > (CH3)CH2+ > CH3+。C–C σ鍵可自由旋轉,碳正離子β位的C-H鍵能與其空p軌道發生σ-p超共軛而使其穩定。能發生超共軛的C-H鍵越多,碳正離子越穩定。
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.