Loading AI tools
来自维基百科,自由的百科全书
范德華引力(英語:van der Waals force)又名范德瓦耳斯力[1],在化學中指分子或稀有氣體原子之間非定向的、無飽和性的、較弱的相互作用力,根據荷蘭物理學家約翰內斯·范德瓦耳斯命名。范德華引力是一種靜電相互作用,但它比化學鍵或共價鍵弱得多,通常其能量小於5kJ/mol。范德華引力的大小和分子的大小成正比。
此條目需要擴充。 (2014年1月5日) |
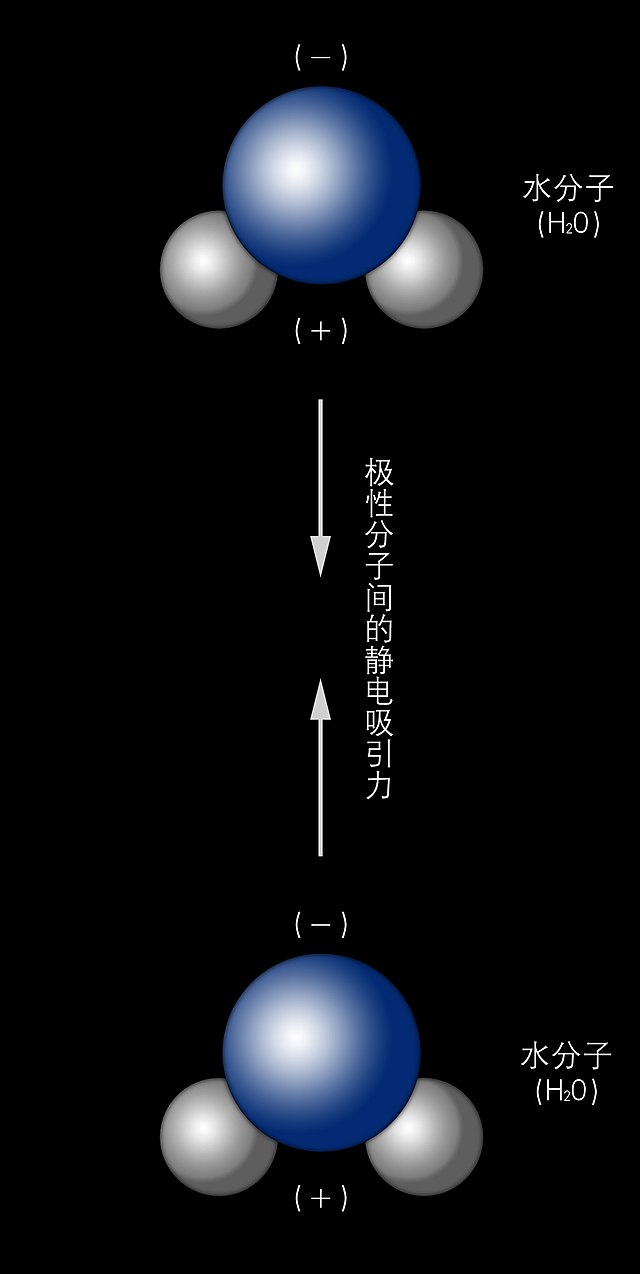
范德華引力的主要來源有三種機制:
范德華引力的大小會影響物質尤其是分子晶體的熔點和沸點,通常分子的分子量越大,范德華引力越大。水(氧化氫)比硫化氫的相對分子質量小,因此范德華引力比後者弱,但由於水分子間存在更強的氫鍵,熔沸點反而更高。壁虎能夠在牆及各種表面上行走,便是因為腳上極細緻的匙突(spatulae)和接觸面產生的范德華引力所致。[2]
對於無極性分子,兩分子間作用力可近似用以下半經驗公式表示:[3]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.