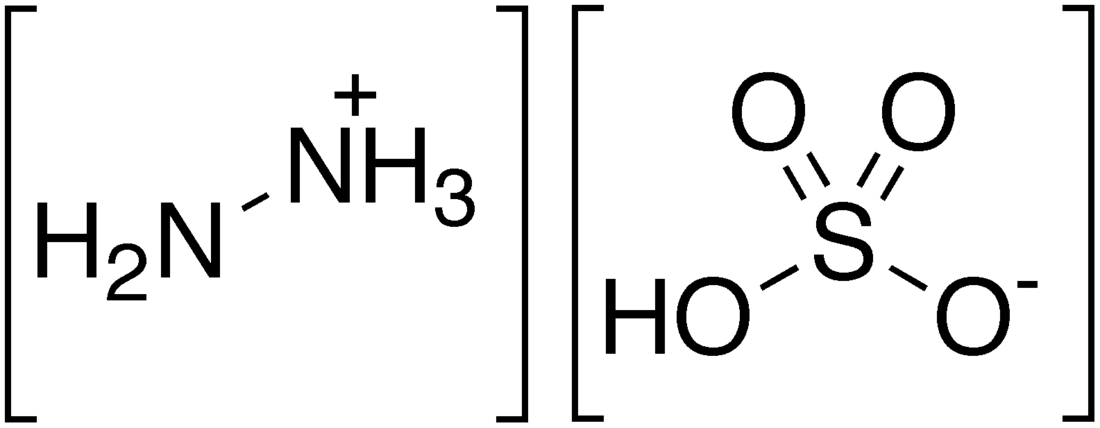热门问题
时间线
聊天
视角
硫酸肼
化合物 来自维基百科,自由的百科全书
Remove ads
硫酸肼[2]是聯氨與硫酸生成的鹽類,指N2H5HSO4和N2H6SO4兩種物質,常寫作N2H4·H2SO4。
Remove ads
N2H6SO4遇水完全水解,產生N2H5HSO4,而N2H5HSO4尚未分離得到固體。[3]N2H6SO4固體在室溫下可以以正交晶系或單斜晶系存在。[4]
Remove ads
性質
無色無味鱗狀結晶或斜方結晶。微溶於冷水,易溶於熱水,水溶液呈酸性。不溶於醇。在空氣中穩定,不易吸濕。為強還原劑。不可與鹼類、氧化劑共存。有毒,致癌。[5][6]
製備
尿素、次氯酸鈉、液鹼在高錳酸鉀存在下反應,製得肼,經蒸餾,再同硫酸發生中和,生成物經冷卻結晶、過濾、乾燥,製得硫酸肼成品。
- NH4HSO4 + N2H4·H2O → N2H5HSO4 + NH3 + H2O
Remove ads
用途
用作有機合成試劑,用於製取偶氮二異丁腈,以及製造藥品、殺蟲劑、滅菌劑等。化學鍍時用作還原劑。也用作塑膠和橡膠的發泡劑等。
硫酸肼在美國是營養補充劑,用以對抗癌症造成的患者厭食、消瘦等症狀。[7][8][9][10] 1970年代中期美國的 Joseph Gold[11][12] 首先提出硫酸肼治療法以控制癌患者惡病質的發展。其原理是癌細胞需要靠葡萄糖的糖酵解來產生能量,而此過程的產物乳酸在肝臟中又經過另一耗能過程——糖異生再轉變為葡萄糖。由於肼是化學性質很活潑的化合物,可能在體內對糖異生中的磷酸烯醇式丙酮酸羧化激酶有抑制作用,因此使用硫酸肼可能阻斷糖異生過程,並因此控制惡病質的發展。[13] 這一替代醫學療法在1990年代中期因《閣樓》成人雜誌創辦人妻子 Kathy Keeton 的宣傳而廣為人知。Keeton 曾用這一方法治療自己的轉移性乳腺癌,[14] 並聲稱自己因使用這一療法而使壽命延長數年。不過至今,硫酸肼療法的效果仍然受到很大的爭議。
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads