热门问题
时间线
聊天
视角
氮化鈉
化合物 来自维基百科,自由的百科全书
Remove ads
氮化鈉 (Na3N)是一種非常不穩定的鹼金屬氮化物。氮化鈉是2002年由馬克斯-普朗克學會的Dieter Fischer及Martin Jansen所合成。合成時,用鈉及氮的原子束在低溫的藍寶石上沈積出氮化鈉[2]。
氮化鈉在室溫為晶體。在低於室溫時會變成非晶體。在攝氏75度以上就會分解為元素鈉及氮氣。
Remove ads
合成
氮化鈉可以用兩種方式合成:用氨基鈉(NaNH2)的熱分解,或是將氮氣和鈉元素直接反應[1]。最常見成功製備氮化鈉的方式是用元素直接反應,由Dieter Fischer、Martin Jansen和Grigori Vajenine發現。第一種用元素反應的方式是分別準備氣態的鈉蒸氣和氮氣,並使兩者維持想要的比例,在有冷卻基質的情形下將其釋放到真空腔體中,再加熱到室溫(298 K)使其結晶[2]。 第二種方式是讓鈉金屬和等離子活化的氮氣在金屬表面反應。此合成反應還可以用液態的Na-K合金進行。之後固體和液體可以用離心機分離。不過此方式對空氣非常敏感,在空氣下會快速分解和燃燒,只有暴露在純氧的環境下才不會燃燒[3]。
特徵
氮化鈉的顏色從紅棕色到深藍色不等,依合成方式而不同[2][3]。氮化鈉在室溫下可以放置數週,都不會分解[3]。氮化鈉沒有熔點,在約360K下進行質譜分析時就分解了[2][1]。預估的標準莫耳生成焓為+64 kJ/mol[3]。
結構
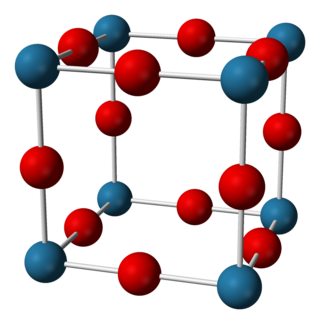
氮化鈉在室溫下有90%是離子態,但是有半導體典型的能隙[1][3]氮化鈉的結構是反ReO3結構,其晶格是由NNa6八面體組成[2][1][3][4] The compound has N−Na bond lengths of 236.6 pm.[2][3]。其結構已由X光繞射以及最近的中子繞射,針對粉末以及晶體分析所確認[2][1][3][4]。
參考資料
參見
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle {2\,\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {N} {}\mathrel {\longrightarrow } {}6\,\mathrm {Na} {}+{}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/23cc48b0c16e3b9f2f04130523d2ec67cbef8b1b)