碘化亞銅(化學式:CuI),即碘化銅(I),白色或無色反磁性粉末,不純時常為棕色。室溫下為閃鋅礦結構,應用很廣。難溶於水和酸,因形成配合物而易溶於氨水、碘化鉀和氰化鉀溶液中。自然界中以碘銅礦形式存在。[2]
| 碘化亞銅 | |
|---|---|

| |
| IUPAC名 Copper(I) iodide 碘化銅(I) | |
| 識別 | |
| CAS號 | 7681-65-4 |
| PubChem | 24350 |
| ChemSpider | 22766 |
| SMILES |
|
| InChI |
|
| InChIKey | LSXDOTMGLUJQCM-REWHXWOFAV |
| 性質 | |
| 化學式 | CuI |
| 摩爾質量 | 190.45 [1] g·mol⁻¹ |
| 外觀 | 純品為白色粉末[1],不純時常帶棕色 |
| 密度 | 5.67 g/cm³(固)[1] |
| 熔點 | 591 °C (864 K)[1] |
| 沸點 | 約1290 °C (1573 K)[1] |
| 溶解性(水) | 0.000020 g/100g(20℃)[1] |
| 溶解性 | 難溶於稀酸[1],溶於3.5mol/L碘化鉀溶液 |
| 結構 | |
| 晶體結構 | 立方緊密堆積[1] |
| 配位幾何 | 四面體型 |
| 相關物質 | |
| 其他陰離子 | 氯化亞銅、氧化亞銅 |
| 其他陽離子 | 碘化銀、碘化亞金 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
製備
可溶銅(II)鹽與碘化鉀或碘化鈉溶液混合,生成的碘化銅很不穩定,立即分解,得到白色的碘化亞銅沉澱和碘單質。[3]這是實驗室中製備碘化亞銅的常用方法,也是分析化學中滴定法測定銅的基礎。
- 2 Cu2+ + 4 I− → 2 CuI + I2
性質
碘化亞銅幾乎不溶於水(0.00042 g/L,25°C),也不溶於酸,但可以和碘離子繼續配位,生成直線型的[CuI2]−離子,從而溶於碘化鉀或碘化鈉溶液中。得到的溶液經稀釋又得到碘化亞銅沉澱,因此可用於純化碘化亞銅樣品。[4]
結構
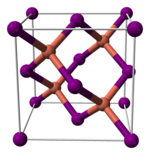
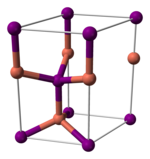
與其它鹵化亞銅(不穩定的氟化亞銅除外)類似,碘化亞銅的晶體在室溫下為閃鋅礦結構(ɣ-CuI),兩種離子都為四面體配位。加熱至390°C時轉變為纖鋅礦結構(β-CuI),若溫度高於440°C,則以氯化鈉型結構存在(α-CuI)。由於碘化亞銅中的銅-鹵素鍵鍵長(2.338 Å)大於另外兩個鹵化亞銅,故碘化亞銅的這兩個轉變溫度比氯化亞銅和溴化亞銅的相應轉變溫度都要低。[5]
高溫下,三種鹵化亞銅的蒸汽中都存在相當數量的環狀三聚體(Cu3X3),也有鹵化亞銅的四聚體存在。
 |
 |
 |
用途
碘化亞銅的用途很廣泛,可用作有機合成催化劑、樹脂改性劑、人工降雨劑、陽極射線管覆蓋物,以及加碘鹽中的碘來源。在1,2-或1,3-二胺配體存在下,碘化亞銅可以催化溴代芳烴、溴代雜環化合物和乙烯基溴轉化為相應碘化物的反應。反應一般在二噁烷溶劑中進行,以碘化鈉作為碘化試劑。芳香碘化物一般比對應的氯化物和碘化物活潑,因此,碘化亞銅可以催化一系列鹵代烴參與的偶聯反應,例如Heck反應、Sonogashira反應,Stille反應、Suzuki反應及Ullmann反應。[6]2-溴-1-辛烯-3-醇與1-壬炔在二氯雙(三苯基膦)合鈀(II)、氯化亞銅和二乙胺存在下,發生偶聯反應生成7-亞甲基-8-十六碳-6-醇。[7]
參見
參考資料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
