玻爾模型
来自维基百科,自由的百科全书
玻爾模型是丹麥物理學家尼爾斯·玻爾於1913年提出的關於原子結構的模型。此模型引入量子化的概念來研究原子內電子的運動,對於計算氫原子光譜的里德伯公式給出了理論解釋。玻爾模型是20世紀初期物理學取得的重要成就,對原子物理學產生了深遠的影響。
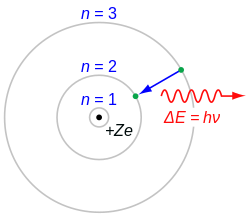
玻爾模型的提出

20世紀初期,德國物理學家普朗克為解釋黑體輻射現象,提出能量量子化假說,揭開了量子理論的序幕。[2]:58-631885年,瑞士數學教師巴耳末將氫原子的譜線表示成巴耳末公式。然而巴耳末公式是經驗公式,直到玻爾在1913年提出玻爾模型為止,人們並不了解它們的物理含義。[3]:143
1911年,英國物理學家盧瑟福根據1909年開始進行的α粒子散射實驗,提出了原子的拉塞福模型。在這個模型里,原子的中心有一個帶正電(Ze)、帶質量的原子核,在原子核的四周是帶負電的電子雲;其中,Z是原子數,e是單位電荷。從拉塞福模型,拉塞福推導出散射公式,其預測與實驗結果相符合。然而,在拉塞福散射實驗裡,主角是原子核,而電子並不重要,因此拉塞福不能空口無憑地給出電子的排列方式,也無法用這模型對於化學結合、元素列表、原子譜線給出解釋。[4][2]:51-53
1912年,正在英國曼徹斯特大學工作的玻爾將一份被後人稱作《曼徹斯特備忘錄》的草稿提交給他的導師盧瑟福。在這份直到玻爾過世後才被發布的草稿中,玻爾在拉塞福模型的基礎上引入了普朗克的量子概念,玻爾提議,原子可以維持力學穩定性,[註 1]前提是電子的動能與電子環繞原子核的公轉頻率,兩者之間的關係式假定為
- ;
其中,與普朗克常數有關。
注意到他並沒有確切給出的形式,也沒有將輻射穩定性納入考量,[註 2]更沒有理論證實他的假定可以達成力學穩定性。[2]:54[3]:135-139
1913年2月4日前後的某一天,玻爾與同事漢斯·漢森討論他的研究,漢森提問:「這研究與譜線方程有甚麼關係?」玻爾回答說他會去查閱這方面的資料。玻爾博覽那時期的科學文獻,而且巴耳末公式在科學文獻裡是常被引述的譜線方程,很可能他已看到過這公式,但並沒有注意到這公式與自己研究有甚麼的關聯,而且已完全忘掉這公式。不論如何,他詳細閱讀了約翰內斯·斯塔克撰寫的教科書(德文)有關譜線方面的內容,特別是關於巴耳末公式的描述,後來他回憶:「就在我看到巴耳末公式的那一瞬間,突然一切都變得清楚了。」[註 3]3月7日,他寫好一篇詮釋巴耳末公式的論文,其開啟了原子結構的量子理論。[3]:144[5]:43
1913年7月、9月、11月,《哲學雜誌》接連刊載了玻爾的三篇論文,[6][7][8]標誌着玻爾模型正式提出。這三篇論文成為物理學史上的經典,被稱為玻爾模型的「三部曲」。[5]:7他在第一篇論文中利用玻爾模型分析了氫原子,在第二篇論文中論述了其它原子結構與週期表,在第三篇論文中探討了分子結構。[3]:149
玻爾模型的主要內容
玻爾模型的兩個主要假設為,[9]:1097-1100
按照第一個假設,在氫原子中的電子,圍繞著原子核做圓周運動,其軌道是經典軌道。電子做圓周運動的向心力是由電子和原子核之間的庫侖力所提供:[9]:1097-1100
- ,
其中, 是電子質量, 是電子速率, 是電子軌道半徑, 是電常數, 是基本電荷。
所以,半徑為
- ,
另外,圓周運動的角動量大小是半徑乘以動量:
- 。
所以,按照第二個假設,速度為
- ,
將速度的表達式代入半徑的表達式,可以得到新的半徑的表達式
- 。
這軌道半徑表達式可以重寫為
- ;
其中, 是玻爾半徑。
在氫原子的波爾模型裡,以原子核為圓心的電子圓周運動的半徑被量子化,最小的半徑是玻爾半徑。由於電子被禁止離原子核更近,庫侖力無法將電子吸引到原子核裡,電子也不會因為進行圓周運動的加速度而釋出電磁波。
電子繞著原子核的軌道能量 是動能 加勢能 :[9]:1097-1100
- 。
將軌道半徑表達式代入軌道能量表達式,可以得到
- 。
在氫原子的波爾模型裡,軌道能量被量子化,並與主量子數的平方成反比。這是束縛電子的能量。由於原子核被假設為固定不動,這能量也可以視為整個氫原子的能量。
電子只能夠穩定地存在於一系列的離散的能量狀態之中,稱為定態。假若電子的能量發生任何變化,都必須要在兩個定態之間以躍遷的方式進行,所以電子只能處於一系列分立的定態。當電子從一個定態躍遷至另一個定態時,會以電磁波的形式放出或吸收能量:[9]:1097-1100
- ,
其中, 是電磁波的頻率。
將軌道能量表達式代入這公式,可以得到
- 。
將這表達式重寫,可以得到里德伯公式:
- 。
其中, 是里德伯常數。
英國光譜學家亞弗列德·福勒質疑:應用玻爾模型計算出里德伯常數的數值;而實驗值,二者相差大約萬分之五。1914年,玻爾提出,這是因為原來的模型假設原子核靜止不動而引起的。實際情況是,原子核的質量不是無窮大,它與電子繞共同的質心轉動。玻爾對其理論進行了修正,用原子核和電子的約化質量代替了電子質量。這樣的話,不同原子的里德伯常數RA不同,
電子到質心的距離仍為原來理論中的第一軌道半徑,與原子核的質量無關。
玻爾模型的實驗驗證
1897年,美國天文學家愛德華·皮克林在恆星弧矢增二十二的光譜中發現了一組獨特的線系,稱為皮克林線系。皮克林線系中有一些譜線靠近巴耳末線系,但又不完全重合,另外有一些譜線位於巴耳末線系兩臨近譜線之間。起初皮克林線系被認為是氫的譜線,然而玻爾提出皮克林線系是類氫離子He+發出的譜線。隨後英國物理學家埃萬斯在實驗室中觀察了He+的光譜,證實玻爾的判斷完全正確。
和玻爾提出玻爾模型幾乎同一時期,英國物理學家亨利·莫塞萊測定了多種元素的X射線標識譜線,發現它們具有確定的規律性,並得到了經驗公式——莫塞萊定律。莫塞萊看到玻爾的論文,立刻發現這個經驗公式可以由玻爾模型導出,為玻爾模型提供了有力的證據。
1914年,詹姆斯·弗蘭克和古斯塔夫·赫茲進行了用電子轟擊汞蒸汽的實驗,即弗蘭克-赫茲實驗。實驗結果顯示,汞原子內確實存在能量為4.9eV的量子態。1920年代,弗蘭克和赫茲又繼續改進實驗裝置,發現了汞原子內部更多的量子態,有力地證實了玻爾模型的正確性。
玻爾模型的推廣
隨着光譜實驗水平的提高,人們發現了光譜具有精細結構。1896年,阿爾伯特·邁克耳孫和愛德華·莫雷觀察到了氫光譜的Hα線是雙線,隨後又發現是三線。玻爾提出這可能是電子在橢圓軌道上做慢進動引起的。1916年索末菲在玻爾模型的基礎上將圓軌道推廣為橢圓形軌道,並且引入相對論修正,提出了索末菲模型。在考慮橢圓軌道和相對論修正後,索末菲計算出了Hα線的精細結構,與實驗相符。然而進一步的研究發現,這樣的解釋純屬巧合。Hα線的精細結構有7條,必須徹底拋棄電子軌道的概念才能完全解釋光譜的精細結構。
玻爾模型的問題
玻爾模型將經典力學的規律應用於微觀的電子,不可避免地存在一系列問題。根據經典電動力學,做加速運動的電子會輻射出電磁波,致使能量不斷損失,而玻爾模型無法解釋為什麼處於定態中的電子不發出電磁輻射。玻爾模型對躍遷的過程描寫含糊。因此玻爾模型提出後並不被物理學界所歡迎,還遭到了包括盧瑟福、薛定諤在內的諸多物理學家的質疑。玻爾曾經的導師、劍橋大學的約瑟夫·湯姆孫拒絕對其發表評論。薛定諤甚至評價說是「糟透的躍遷」[10]。
此外,玻爾模型無法揭示氫原子光譜的強度和精細結構,也無法解釋稍微複雜一些的氦原子的光譜,以及更複雜原子的光譜。因此,玻爾在領取1922年諾貝爾物理學獎時稱:「這一理論還是十分初步的,許多基本問題還有待解決。」
玻爾模型引入了量子化的條件,但它仍然是一個「半經典半量子」的模型。完全解決原子光譜的問題必須徹底拋棄經典的軌道概念。儘管玻爾模型遇到了諸多困難,然而它顯示出量子假說的生命力,為經典物理學向量子物理學發展鋪平了道路。
參閱
註釋
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
































