氧化铟
化合物 来自维基百科,自由的百科全书
氧化铟是一种无机化合物,化学式为In2O3,是一种两性氧化物,且为铟最稳定的氧化物。
| 氧化铟(III) | |
|---|---|
| |
| 别名 | 三氧化二铟 |
| 识别 | |
| CAS号 | 1312-43-2 |
| PubChem | 150905 |
| ChemSpider | 133007 |
| SMILES |
|
| InChI |
|
| InChIKey | PJXISJQVUVHSOJ-UHFFFAOYAL |
| 性质 | |
| 化学式 | In2O3 |
| 摩尔质量 | 277.64 g/mol g·mol⁻¹ |
| 外观 | 黄绿色晶体粉末 |
| 气味 | 无臭 |
| 密度 | 7.179 g/cm3 |
| 熔点 | 1910 °C(2183 K) |
| 溶解性(水) | 难溶 |
| 能隙 | ~3 eV (300 K) eV |
| 结构 | |
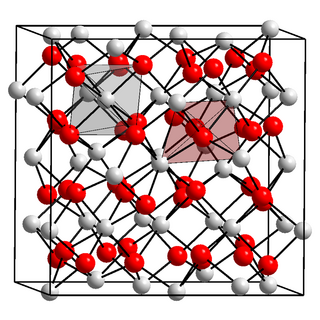
| 晶体结构 | Cubic, 空间群 Ia3 No. 206, cI80, a = 1.0117(1) nm, Z = 16[1] |
| 危险性 | |
| 欧盟分类 | 未列出 |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 硫化铟 硒化铟 碲化铟 |
| 其他阳离子 | 氧化硼 氧化铝 氧化镓 氧化铊 |
| 相关化学品 | 氢氧化铟 氧化铟(I) 氧化铟(II) |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
块状样品可通过铟(Ⅲ)的氢氧化物、硝酸盐、碳酸盐或硫酸盐的热分解来制备[2]。氧化铟的薄膜可以通过在氩/氧气中铟靶的溅射沉积来制备。它们可被用作半导体的扩散阻挡层(“阻挡金属”),例如可抑制铝和硅之间的扩散[3]。
化学性质
氧化铟在700℃分解为氧化亚铟(一氧化二铟),其于2000℃进一步分解。
淡黄色的氧化铟可溶于酸和碱,但棕红色的相对难溶。[4]和氨在高温下反应,形成氮化铟。[5]
- In2O3 +2NH3 → 2InN + 3H2O
- In2O3 + 3 H2 → 2 In + 3 H2O
- In2O3 + 2 H2 → In2O + 2 H2O
氧化铟和Cs2O在600℃反应,可以得到无色吸湿性的偏铟酸铯(CsInO2)[4];K2O和铟可以形成分子式为K5InO4的化合物,其中有四面体结构的InO45−。[7]
和一些三价金属氧化物反应,可以形成钙钛矿结构的化合物[8],例如:
- In2O3 + Cr2O3 → 2 InCrO3
应用
氧化铟被使用在一些类型的电池,对可见光透明的薄膜红外线反射镜(热镜),一些光学涂层,有的抗静电涂料。二氧化锡的组合,氧化铟形式的氧化铟锡(也称为锡掺杂的氧化铟或ITO)用于透明导电涂层的材料。
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.