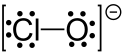次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO−,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。常见的次氯酸盐包括次氯酸钠(漂白剂)和次氯酸钙(漂白粉),都是很强的氧化剂,可与很多有机化合物强烈放热反应,可能发生燃烧。可氧化锰化合物为高锰酸盐。次氯酸根中的 Cl-O 键长是 210 pm。[1]
反应
次氯酸盐和酸反应形成次氯酸,并和氯气形成平衡。在高pH下平衡会趋向左边:
- 2 H+
+ ClO−
+ Cl−
⇌ Cl
2 + H
2O
次氯酸盐普遍不稳定,只能存在于溶液。次氯酸锂(LiClO)、次氯酸钙(Ca(ClO)2)和次氯酸钡(Ba(ClO)2)已经得到了纯的无水物。它们都是固体。剩下的都只能以水合物或水溶液的形式存在。一般来说,水溶液越稀就越稳定。对于碱土金属次氯酸盐的性质推测是不可能的,因为大部分次氯酸盐都仍未合成。次氯酸铍不存在。纯的次氯酸镁不存在,不过Mg(OH)ClO是已知的。[3] 次氯酸钙的生产已是工业级的了,稳定性也较好。次氯酸锶(Sr(ClO)2)的性质及稳定性都不明确。[来源请求]
- 2 ClO−
→ 2 Cl−
+ O
2 - 3 ClO−
→ 2 Cl−
+ ClO−
3
这个反应是放热的,因此纯的LiClO和Ca(ClO)2会导致热失控,可能会爆炸。[4]
碱金属次氯酸盐随着族往下,越来越不稳定。无水次氯酸锂在室温下稳定。不过,次氯酸钠已经不能合成到比五水物 (NaClO·(H2O)5)更干的次氯酸钠了。它在 0 °C以上是不稳定的,[5] 尽管作为家用漂白剂的稀次氯酸钠溶液具有更好的稳定性。次氯酸钾 (KClO) 只在溶液中存在。[3]
镧系元素次氯酸盐不稳定。不过,有报告称它们的无水物比水合物更稳定。[6] 次氯酸盐可以把铈的氧化态从 +3 氧化到+4。[7]
次氯酸盐和氨反应,形成氯胺 (NH
2Cl),之后是二氯胺 (NHCl
2),最后是三氯化氮 (NCl
3)。[8]
- NH
3 + ClO−
→ HO−
+ NH
2Cl
- NH
2Cl + ClO−
→ HO−
+ NHCl
2
- NHCl
2 + ClO−
→ HO−
+ NCl
3
检验
溶解性
参见
- 次氯酸酯
参考资料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.