多替拉韦
化合物 来自维基百科,自由的百科全书
多替拉韦(英语:dolutegravir,简称DTG)以商品名称Tivicay(特威凯)等于市面上销售,是一种抗反转录病毒药物,用途为与其他药物联合,以治疗爱滋病。[6]其他用途为预防暴露后的潜在爱滋病感染。[6]此药物系透过口服方式给药。[6]
 | |
 | |
| 临床资料 | |
|---|---|
| 商品名 | Tivicay及Tivicay PD |
| 其他名称 | GSK572, S-349572 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a613043 |
| 核准状况 | |
| 怀孕分级 | |
| 给药途径 | 口服给药 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 药物动力学数据 | |
| 生物利用度 | n/a[4] |
| 血浆蛋白结合率 | ≥98.9% |
| 药物代谢 | UDP-葡萄糖醛酸基转移酶1-1及细胞色素P450 3A4酶CYP3A4 |
| 生物半衰期 | ~14小时 |
| 排泄途径 | 粪便 (53%) 及尿液 (18.9%) |
| 识别信息 | |
| |
| CAS号 | 1051375-16-6 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB配体ID | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.237.735 |
| 化学信息 | |
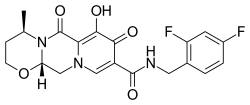
| 化学式 | C20H19F2N3O5 |
| 摩尔质量 | 419.38 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
使用后常见的副作用有睡眠困难、感觉疲倦、腹泻、高血糖和头痛。[7]严重的副作用有过敏反应和肝脏问题。[7]经进一步研究,个体于怀孕期间使用多替拉韦可能对婴儿造成伤害的担忧遭到推翻,这些研究显示使用多替拉韦导致的神经管缺陷,与其他抗逆转录病毒药相比没有统计学上的差异。[8]目前尚不清楚个体于母乳哺育期间使用,对于婴儿是否安全。[7]多替拉韦是一种爱滋病毒整合酶抑制剂,可阻断病毒复制时所需的整合酶功能。[7]
多替拉韦于2013年在美国被批准用于医疗用途。[7]也被列入世界卫生组织基本药物标准清单之中。[9]市面上有一种经核准用于治疗爱滋病,称为阿巴卡韦/度鲁特韦/拉米夫定的复方药,是多替拉韦加上阿巴卡韦和拉米夫定的组合。[7][10][11]截至2019年,世界卫生组织 (WHO) 建议将DTG作为所有爱滋病患者的第一线和第二线治疗药物。[12]
医疗用途
多替拉韦被批准用于治疗广泛的爱滋病患者群体。它可用于从未接受过爱滋病治疗药物(称为treatment-naïve)的成人患者,和先前接受过爱滋病治疗药物(称为treatment-experienced)的成人患者,包括已接受过其他整合酶抑制剂治疗的成人患者。 Tivicay也被批准用于12岁及以上,体重至少40公斤的儿童,这些儿童未接受过治疗,或是曾接受过治疗,但之前未使用过整合酶抑制剂类药物。[13]
在欧盟是把多替拉韦与其他抗逆转录病毒药物结合使用,用于治疗感染爱滋病毒的成人、青少年和六岁以上儿童患者。[5]
美国于2020年6月把多替拉韦的适应症更新为包括至少4周大且体重至少3公斤(6.61磅)的儿童。[14]
不良影响
在临床试验中,使用多替拉韦的常见副作用有失眠和头痛。严重的副作用是同时感染B型肝炎或C型肝炎的患者会发生过敏反应和肝功能异常。[15]药物包装说明书列有黑框警告 - 由于药物抑制肾小管分泌肌酸酐,使用者血清肌酸酐会平均升高0.11毫克/分升(mg/dL),但不影响肾丝球过滤率(GFR) 。[4]
人们于2019年曾短暂担心过[16]个体于怀孕期间使用此药物,可能会导致胎儿的神经管缺陷风险增加,但进一步研究发现多替拉韦和其他抗逆转录病毒药物之间并无统计学差异,而将此疑虑推翻。 [8]截至2024年1月31日,[17]多替拉韦是美国国家卫生院 (NIH)对于怀孕或打算怀孕族群的首选抗逆转录病毒药物。[18]
历史
美国食品药物管理局(FDA)于2013年2月宣布将加速多替拉韦的审核流程,[19]并于2013年8月13日批准其用于医疗用途。[20]多替拉韦于2013年11月4日获得加拿大卫生部批准。[21]欧盟执行委员会于2014年1月16日批准此药物可在整个欧盟使用。[5]
多替拉韦于2020年6月在美国获得批准,适用于与其他抗病毒药物联合治疗至少4周大且体重至少3公斤(6.61磅)儿童的爱滋病毒1型(HIV-1)感染 - 治疗至少4周大、体重3公斤、从未接受过爱滋病治疗,[14]或是已接受过治疗但未使用过整合酶抑制剂类药物的儿童。[14][22]
ViiV Healthcare制药(迄2023年12月,为葛兰素史克、辉瑞与盐野义制药三家共同投资的公司)生产的两种商业品牌药物 - Tivicay和Tivicay PD均获得FDA颁发的适用医疗用途核准。[14]
取得
哥伦比亚政府于2024年4月发布有史以来首次的强制许可,让药厂得以生产多替拉韦的通用名药物,[23][24]原因为虽然透过药品专利池可取得制造该种药物的授权,但哥伦比亚并不在授权范围内。[25]联合国爱滋病规划署支持哥伦比亚采取的决定。[26]但ViiV Healthcare制药对此强制许可并不同意。[27]而是与药品专利池制定单独协议,允许哥伦比亚分销多替拉韦的通用名药物,但仅限用于儿童治疗。[28]
根据一份于2021年10月发表的文章,已有十家药物制造商在药品专利池与ViiV Healthcare制药的授权下向低中收入国家供应WHO预先认证或FDA批准的通用名多替拉韦。[29]
气候变化
全球低收入和中等收入国家有2,400万爱滋病患者使用多替拉韦,此药物的制造较先前的护理标准药物依非韦伦的可显著减少碳排放。[30]这是第一份针对广泛使用药物与其替代品相比,所造成环境影响的报告。据全球性健康倡议组织联合国爱滋病药物机制称,由于转换用药,将可在2017年至2027年间防止超过2,600万吨二氧化碳排放进入大气,相当于排除瑞士日内瓦为期10年的碳排放量。[31]
参见
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
