Remove ads
卷曲螺旋(英语:coiled coil)是一种蛋白质超二级结构,由2-7[1]个α螺旋(最常见的是2或4个)互相缠绕形成麻花状结构。许多具有重要生物学功能(如基因表达调控中的转录因子)蛋白质含有卷曲螺旋。


许多含有卷曲螺旋结构的蛋白质具有重要的生物学功能,例如基因表达的调控中的转录因子。含有卷曲螺旋结构最知名的蛋白质有原癌蛋白(oncoprotein)c-fos和jun,以及原肌球蛋白(tropomyosin,一种肌肉蛋白)。
在莱纳斯·鲍林和他的同事于1951年提出α螺旋结构[2]后不久,弗朗西斯·克里克就于1952年提出了α-角蛋白中可能存在由α螺旋互相缠绕而形成卷曲螺旋。[3]
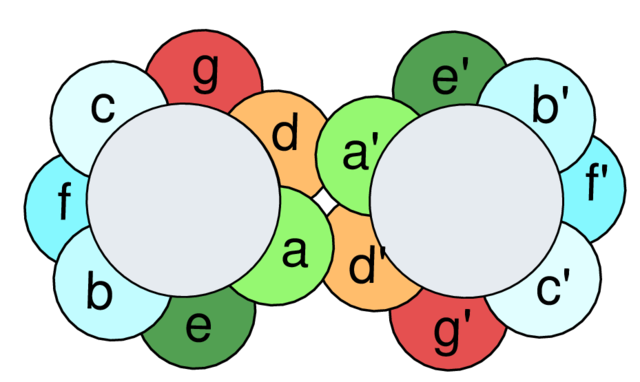
形成卷曲螺旋的蛋白质序列中通常具有序列重复现象,每个重复序列区含有七个氨基酸,被称为七肽重复区(heptad repeat)。卷曲螺旋中螺旋之间相互作用的表面常含有疏水氨基酸,如亮氨酸,而由亮氨酸在相互作用表面的排列就形成了“亮氨酸拉链”(亮氨酸如同拉链一般相互作用)。在细胞质这样一个水环境中,两个螺旋排列在一起最好的方式就是将它们的疏水氨基酸相对,而亲水氨基酸则朝外;这样就使得疏水表面不会暴露于水环境中。这种对疏水表面的包埋为两个螺旋的二聚化提供了热力学驱动力。
形成卷曲螺旋的α螺旋之间的关系可以是平行的或反平行的,并且这些α螺旋通常采用“左手”型超螺旋。少量“右手”型卷曲螺旋也存在于自然界中,或者通过蛋白质工程设计而达成。[4]

艾滋病毒(HIV)侵入人体细胞中关键的一个步骤是由反平行卷曲螺旋构成的gp41三聚体的暴露。gp41三聚体一般是被另一个病毒表面糖蛋白gp120所覆盖,以保护gp41免受抗体识别。当病毒结合到靶细胞上时,gp120发生结构变化,将gp41三聚体暴露出来使得gp41的疏水N端尾部插入靶细胞的细胞膜。gp41上的三个α螺旋折叠到gp41的卷曲螺旋三聚体上形成六聚体,并将病毒外膜与靶细胞的细胞膜拉到足够近而发生膜融合。然后,病毒就可以进入细胞,开始自身复制。
由于卷曲螺旋的特异性作用并且常常形成二聚体,因此卷曲螺旋被用作二聚化的标签应用于需要二聚化的蛋白质。
Remove ads
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
Remove ads