绝热过程
概念 来自维基百科,自由的百科全书
绝热过程(英语:adiabatic process)是一个绝热体系的变化过程,绝热体系为和外界没有热量和粒子交换,但有其他形式的能量交换的体系,属于封闭体系的一种。绝热过程有绝热压缩和绝热膨胀两种。常见的一个绝热过程的例子是绝热火焰温度,该温度是指在假定火焰燃烧时没有传递热量给外界的情况下所可能达到的温度。现实中,不存在真正意义上符合定义的绝热过程,绝热过程只是一种近似,所以有时也称为绝热近似。
绝热过程分为可逆过程(熵增为零)和不可逆过程(熵增不为零)两种。可逆的绝热过程是等熵过程。等熵过程的对立面是等温过程,在等温过程中,最大限度的热量被转移到了外界,使得系统温度恒定如常。由于在热力学中,温度与熵是一组共轭变量,等温过程和等熵过程也可以视为“共轭”的一对过程。
如果一个热力学系统的变化快到足以忽略与外界的热交换的话,这一变化过程就可以视为绝热过程,又称“准静态过程”。准静态过程的熵增可以忽略,所以视作可逆过程,严格说来,在热力学中,准静态过程与可逆过程没有严格区分,在某些文献中被作为同义词使用。
同样的,如果一个热力学系统的变化慢到足以靠与外界的热交换来保持恒温的话,该过程则可以视为等温过程。
绝热压缩与绝热膨胀
绝热压缩与绝热膨胀通常由气体压强的变化引起。
绝热压缩发生在气压上升时,这时气体温度也会上升。例如,给自行车打气时,可以感觉到气筒温度上升,这是因为气体将压缩其所做的功转换成自身的内能,因而温度上升。柴油机在压缩冲程时正是靠绝热压缩原理来给燃烧室内的混合气体点火的。
绝热膨胀发生在气压下降时,这时气体温度也会下降。例如,给轮胎放气时,可以明显感觉到放出的气体比较凉,这是因为气体从轮胎的充气孔出来时,先被小洞压缩后瞬间膨胀的缘故,气体为了膨胀,因此将周遭空气“撑开”,过程中需要做功,消耗了自身内能,使温度下降。
这些温度的变化量可以用理想气体状态方程精确计算。
用理想气体状态方程求解绝热过程
对于经典气体(非费米气体、玻色气体)的方程如下,是一个多方方程:
- 常数
其中:
对于绝热过程有:
其中C为常数。
绝热过程的热力学第一定律具体形式如下:
因为绝热过程没有热交换,所以,由热力学第一定律,有
dU为系统内能的变化量;δW是系统所做的功,做功必须耗费内能。由于δQ为零,可以得到
- 。
理想气体的内能可以由如下式子得到:
R为理想气体常数;n为系统粒子的物质的量(因为绝热过程无粒子交换,所以恒定不变);。
对(3)式两边微分,代入理想气体状态方程得到
- 。
因为,(4)式通常写作
将(2,3,4)代入到(1),有:
简化得到:
两边同除以PV
- 。
分别对P、V积分,得到
- 。
两边分别取幂:
消去负号:
- 。
因此得到:
和
Const为常数。
从状态1到状态2,系统的内能变化为:
同时,气体做功为:
因为绝热,所以有:
将(1,2)式分别带入得到:
或:
因为实际情形下,通常可以假定气体质量数不变,该式可以简化为:
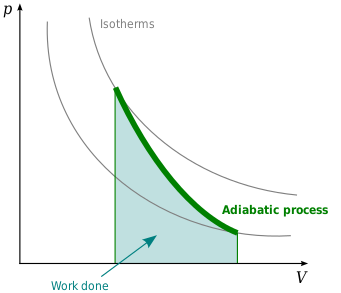
等熵线图

等熵线又称绝热线,是指P-V图中等熵的一条曲线,如右图黑色线条所示。等熵线有以下性质:
- 像等温线一样对称的趋近V轴与P轴。
- 每条等熵线只穿过同一条等温线一次。
- 等熵线与等温线相似,但斜率更大。
- 若等温线凹向45度方向处,则等熵线凹向31度方向处。
- P-V图上一系列的等温—等熵线所绘出的眼形方块显示出向原点方向移动的趋势。参见能斯特定理。
右图是绝热线和等温线叠加的一个P-V图。
参见
参考文献
- 汪志诚. 《热力学与统计物理(第三版)》. 高等教育出版社. 2003年3月.
- 吴大猷. 《热力学、气体运动论及统计物理》. 科学出版社. 1983年7月.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


































