Loading AI tools
З Вікіпедії, вільної енциклопедії
Гідроксикисло́ти, о́ксикисло́ти, — похідні карбонових кислот, в яких один або кілька атомів гідрогену заміщені на гідроксильні (спиртові) групи. Іноді їх називають спиртокислотами.
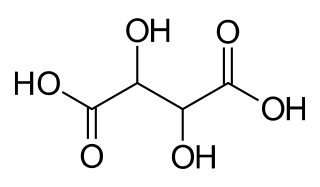
Кількість карбоксильних груп, що містяться в молекулі кислоти, визначає її основність. За кількістю гідроксилів, включаючи гідроксили карбоксильних груп, визначають атомність гідроксикислот. Залежно від кількості карбоксильних груп, що містяться в молекулах таких сполук, розрізняють одно-, двох- і триосновні гідроксикислоти. За кількістю гідроксильних груп, що містяться в молекулах цих сполук, розрізняють двох-, три- і багатоатомні гідроксикислоти. За місцем розміщення групи -ОН у радикалі розрізняють α-, β-, γ-, σ-гідроксикислоти.
Окрім структурної ізомерії, для α-гідроксикислот характерна оптична ізомерія. Це явище зумовлене просторовим розміщенням атомів і атомних груп у молекулах гідроксикислоти. В молекулі оптичного ізомеру є асиметричний атом (або кілька атомів) карбону. Це такий атом карбону, кожна валентність якого сполучена з одним із різних атомів або груп атомів. Його називають хіральним центром. Прикладом такого асиметричного атома може бути атом карбону в центрі молекули 2-оксипропанової ("молочної) кислоти. Для 2-оксипропанової кислоти, що має розгорнуту формулу СН3СНОНСООН, існує два оптичних ізомери (правий і лівий — D- і L-) та їх рівнозначна, оптично неактивна суміш — рацемат. Такий вид ізомерії іноді називають дзеркальною, оскільки правий і лівий ізомери однієї й тієї самої гідроксикислоти являють собою дзеркальне відображення один одного. Дзеркальні ізомери оптично активні: один з них обертає площину поляризації світла вправо другий — вліво. Тому їх називають оптичними антиподами. Хіральність є одним із випадків стереоізомерії.
Гідроксикислоти дуже поширені в природі. Наприклад, 2-оксипропанова, лактатна кислота, — складова частина кислого молока, квашених овочів і фруктів, силосу; 2,3-діоксибутандіова, тартратна кислота, — складова багатьох вин, де вона міститься у вигляді калієвих і натрієвих солей тощо.
Окремим гідроксикислотам — 2-оксипропановій (лактатній), 2-оксибутандіоновій (яблучній), 2-оксипропан-1,2,3-триовій (цитратній), ізоцитратній — належить важлива роль в обміні речовин у циклі трикарбонових кислот Кребса — ЦТК у клітинах живих організмів тощо.
Лактатну кислоту найчастіше добувають ферментативним бродінням меляси, картоплі та інших цукристих продуктів з послідовним перетворенням на кальцієві або цинкові солі, їх концентруванням і підкислюванням сульфатною кислотою, синтетично — гідролізом лактонітрилу. Лактатна кислота утворюється в процесі молочнокислого бродіння цукристих речовин під впливом молочнокислих бактерій:
C6H12O6 → 2 СН3СН(ОН)СООН.
Гексоза Лактатна кислота
Синтетично цитратну кислоту добувають з ацетону. Але доцільно добувати її і біохімічним методом — лимоннокислим бродінням глюкози під дією ферментів пліснявих грибів (С. П. Костичев і В. С. Буткевич, 1935). Крім того, цитратну кислоту добувають з тютюну за методом О. О. Шмука (1942), де її вміст досягає 8 % загальної маси.
Гідроксикислоти — хімічно активні речовини. Наявність у складі їхніх молекул двох видів функціональних груп (-СООН і -ОН) дає їм змогу легко вступати в різні хімічні реакції, характерні для карбонових кислот, спиртів і типові для самих гідроксикислот.
Гідроксикислоти легко вступають у реакції окиснення за спиртовими групами, що зумовлює утворення оксикислот — альдегідо- і кетокислот. Наприклад, лактатна кислота, окислюючись, перетворюється на піровиноградну:
2СН3СН(ОН)СООН + [О] → 2СН3СН(=О)СООН + Н2О
лактатна кислота піровиноградна кислота
При нагріванні з концентрованою сульфатною кислотою цитратна кислота спочатку розкладається на форміатну і ацетондикарбонову кислоти:
НООС-СН2-С(ОН)(СООН)-СН2-СООН + Н2SO4 = НСООН + НООС-СН2-С(=О)-Н2С-СООН Цитратна кислота Форміатна кислота Ацетондикарбонова кислота
В подібну реакцію вступає і лактатна кислота:
СН3СН(ОН)СООН + Н2SO4 = НСООН + СН3-С(Н)=О лактатна кислота Форміатна кислота етаналь
Оксикислоти реагують з гідроксидами або солями металів, утворюючи кислі або середні солі. Наприклад, утворення кислої і середньої солей тартратної кислоти: На першій стадії утворюється кисла сіль тартратної кислоти, яка майже не розчиняється у воді:
НООС–СНОН–СНОН–СООН + КОН = НООС–СНОН–СНОН–СООК + Н2О Тартратна кислота Гідрогенкалій тартрат
На другій стадії утворюється середня сіль, яка добре розчиняється у воді:
НООС–СНОН–СНОН–СООК + КОН = КООС–СНОН–СНОН–СООК + Н2О Гідрогенкалій тартрат калій тартрат
При взаємодії лактатної кислоти й гідроксиду цинку утворюється лактат цинку:
2 СН3СН(ОН)СООН + Zn(OH)2–>(СН3СН(ОН)СОО)2Zn + 2 H2O Лактатна кислота Лактат цинку
Цитратна кислота реагує з хлоридом кальцію утворюючи цитрат кальцію:
2НООС-СН2-С(СООН)(ОН)-СООН + 3CaCl2 = Ca3[ООС-СН2-С(СОО)(ОН)-СОО]2 + 6HCl Цитратна кислота цитрат кальцію
α-гідроксикислоти в присутності мінеральних кислот утворюють циклічні естери — лактиди:

β-гідроксикислоти при нагріванні відщеплюють воду з утворенням ненасичених карбонових кислот:
γ- та δ-гідроксикислоти при нагріванні утворюють внутрішні циклічні естери — лактони:

Лактатна кислота СН3СН(ОН)СООН — одна з найпоширеніших у природі гідроксикислот. За фізичними властивостями вона є рідина, добре розчиняється у воді й органічних розчинниках. Має специфічний запах. Існує у вигляді лівої L-лактатної кислоти, правої D-лактатної кислоти і рацемату — D, L-лактатної кислоти. Солі та естери лактатної кислоти називають лактатами. Лактатну кислоту використовують (у вигляді рацемату) для виробництва лікарських засобів (наприклад, лактату феруму), протравного фарбування, як пластифікатор тощо.
Тартратна кислота (2,3-діоксибутандіова) НООС-СНОН-СНОН-СООН у складі своїх молекул має два асиметричних атоми карбону й існує у вигляді D-тартратної (виннокам'яної, правообертальної), L-тартратної (лівообертальної), D,L-тартратної (рацемічної, виноградної) і мезовинної (оптично недіяльної внаслідок внутрішньої компенсації обертання площини поляризації світла обома її половинами) кислот.
Цитратна кислота — безбарвна кристалічна речовина, плавиться при 153 °C, добре розчиняється у воді (133 г в 100 мл води). Вперше добута з лимонного соку, з якого нині добувають її на Гавайських островах, у Сицилії, Каліфорнії, Греції. Використовується в харчовій промисловості та побуті як смаковий і консервуючий засіб. Цитрат натрію застосовують як препарат, що запобігає зсіданню крові. Цитратна кислота — важливий проміжний продукт обміну вуглеводів в організмі тварин і людини.
Яблучна кислота HOOC-CH(OH)-CH2-COOH — двоосновна органічна оксикарбонова кислота. Існує в L- та D-формах, а також у рацемічній (оптично неактивній) DL-формі. В природі міститься у барбарисі, винограді, яблуках, малині, горобині, стеблах ревеня, листках махорки. У розчинах тютюну міститься у вигляді солей нікотину. У медицині — складова частина послаблюючих засобів та препаратів від хрипоти. Сприяє засвоєнню заліза та включена до складу гемоглобіну. Яблучна кислота — проміжний продукт при тканинному диханні, різних типах бродіння. Одержують з плодів горобини і барбарису, застосовують у кондитерському виробництві, у медицині.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.