Топ питань
Часова шкала
Чат
Перспективи
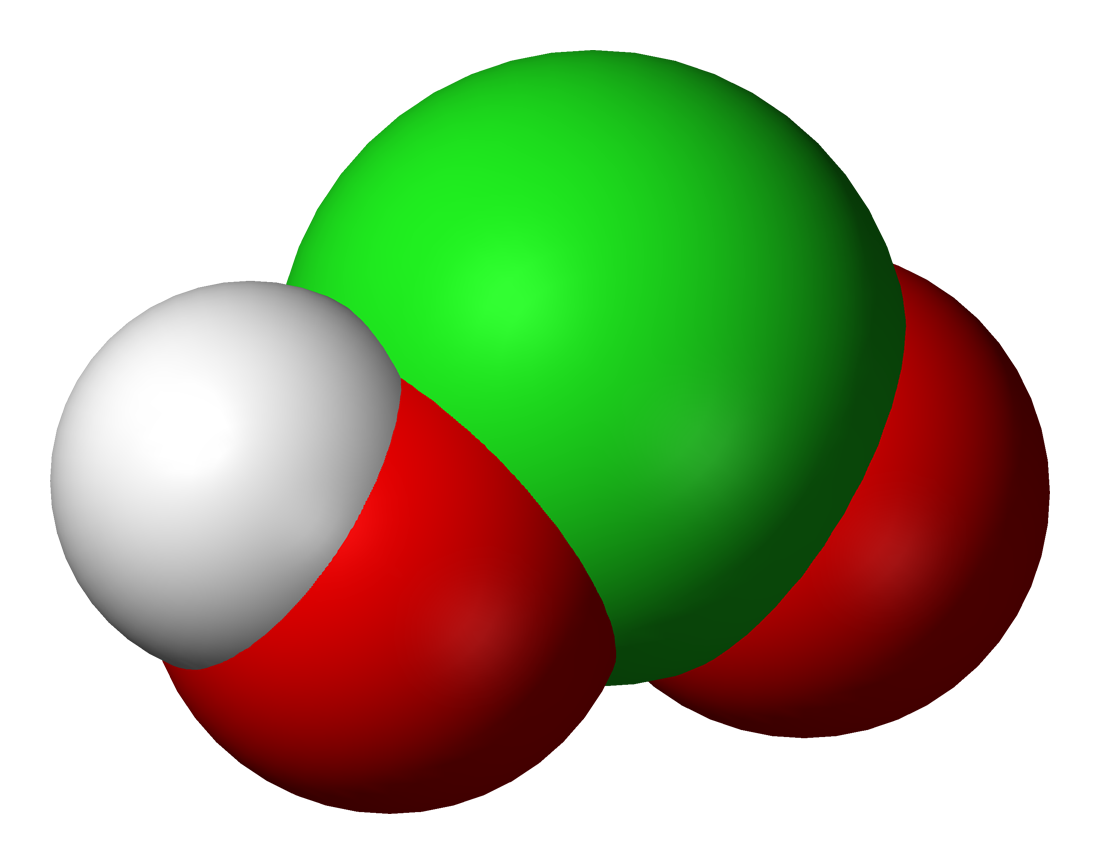
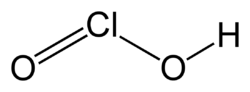
Хлоритна кислота
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
Хлоритна кислота HClO2, односновна кислота середньої сили.
Remove ads
Властивості
Хлоритна кислота HClO2 у вільному вигляді нестійка, навіть у розбавленому водному розчині вона швидко розкладається:
- 4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Ангідрид цієї кислоти невідомий.
Отримання
Розчин кислоти отримують з її солей - хлоритів, що утворюються в результаті взаємодії ClO2 з лугом:
- 2ClO2 + Н2O2 + 2NaOH → 2NaClO2 + O2 + 2H2O
і далі за реакцією:
- Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
Солі хлоритної кислоти називаються хлорити, вони, як правило, безбарвні і добре розчинні у воді. На відміну від гіпохлоритів, хлорити проявляють виражені окислювальні властивості тільки в кислому середовищі. З солей найбільше застосування має хлорит натрію NaClO2, який застосовується для відбілювання тканин і паперової маси. Хлорит натрію отримують за реакцією:
- 2ClO2 + PbO + 2NaOH → PbO2 + 2NaClO2 + H2O
Безводний NaClO2 вибухає при ударі і нагріванні; запалюється при контакті з органічними речовинами, гумою, папером і т. п.
Remove ads
Див. також
Джерела
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Луцевич Д. Д. Довідник з хімії, Українські технології, Львів 2003, 420 ст.
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads