Прості речовини
З Вікіпедії, вільної енциклопедії
Прóстá речови́на — хімічна речовина, структурні одиниці якої: або є представниками; або складаються з атомів, тільки одного хімічного елементу. Еталонний стан (хімічного елемента, простої речовини) (reference state (of an element)) — стан, в якому хімічний елемент (проста речовина) є стабільним при вибраних за стандартні умовах — тиску та температурі.
| Прості речовини | |
| Наступник | бінарні сполуки |
|---|---|
Загальні відомості
Узагальнити
Перспектива
Наприклад, до простих речовин належать: водень, азот, озон тощо, бо молекули водню H2 складаються тільки з атомів водню, молекули азоту N2 — тільки з атомів азоту, молекули озону O3 — тільки з атомів кисню. Деякі прості речовини складаються безпосередньо з атомів: так, газ гелій складається лише з атомів гелію He; газ аргон — лише з атомів аргону Ar. Всі інші благородні гази також складаються з атомів лише одного хімічного елементу.
Простим речовинам протиставляються складні речовини, структурні одиниці (молекули або інші формульні одиниці (якщо речовина немолекулярна)) яких, на відміну від перших, складаються з хімічнопов'язаних атомів різних хімічних елементів.
Прості речовини є формою існування хімічних елементів у вільному (чистому) вигляді, бо атоми всіх хімічних елементів в присутності інших атомів не можуть існувати ізольовано (інакше кажучи, елементи, не пов'язані хімічно ні з яким іншим елементом, утворюють прості речовини).
За властивостями окремих простих речовин, класифікують відповідні хімічні елементи у періодичній системі хімічних елементів.
Всі прості речовини є чистими речовинами. Число простих речовин значно перевищує число відомих хімічних елементів. Відомо близько 500 простих речовин[1][2].
Класифікація
Узагальнити
Перспектива
Прості речовини в залежності від наявності або ненаявності в них тих чи інших ознак, властивостей класифікують наступними методами:
За типом хімічного зв'язку
В залежності від типу хімічного зв'язку між атомами простих речовин, останні зазвичай розділяють на два класи:
- Метали — прості речовини, в яких атоми між собою сполучені металічними зв'язками, та які являють собою ковкі, пластичні тверді тіла, що мають металічний блиск, здатні добре проводити тепло та електричний струм. Переважна більшість простих речовин є металами.
- Неметали — прості речовини, які не є металами. Неметали не мають такої схожості у властивостях, як метали.
| Порівняння металів та неметалів | |
|---|---|
| Метали | Неметали |
| Мають металічний блиск | Не мають металічного блиску |
| Електропровідні | Не електропровідні |
| Теплопровідні | Погано проводять тепло |
| Тверді тіла | Гази, тверді тіла |
| Ковкі, пластичні | Крихкі |
| Температури плавлення високі | Температури плавлення низькі |
Таку класифікацію простих речовин запропонував видатний французький вчений А.Л. Лавуазьє в кінці XVIII сторіччя[3]. Хімічні елементи, від яких походять метали, називають металічними, а ті, що утворюють неметали, — неметалічними. Чіткої межі між металами та неметалами не існує. Деякі неметали виявляють металічні властивості, а метали — неметалічні. Так, графіт проводить електричний струм, а олово — дуже крихкий метал. Незважаючи на умовність поділу простих речовин на метали і неметали, його вважають доволі зручним.
За типом структурної одиниці
В залежності від того з яких структурних одиниць складаються ті чи інші прості речовини, останні зазвичай відносять до двох класів:
- Молекулярні речовини — хімічні речовини, структурними одиницями для яких є молекули[4]. Молекулярними простими речовинами є відносно невелика група неметалів, здебільшого двоатомних: водень H2, азот N2, кисень O2, фтор F2, діфосфор[en] P2. А також прості речовини, молекули яких складені більш ніж з двох атомів: озон O3, білий фосфор P4, гексасірка[en] S6, октасірка[en] S8, жовтий арсен As4, й також алотропні модифікації вуглецю — різні фулерени (C60, C70, C540) та вуглецеві нанотрубки, тощо.
- Немолекулярні речовини — хімічні речовини, структурними одиницями для яких є: або безпосередньо атоми; або групи атомів поєднані між собою хімічними зв'язками та при цьому не є молекулами[4]. Ними за звичайних умов є всі метали та благородні гази, а також всі інші неметали, що не перераховані вище.
За наявністю хімічного зв'язку
Прості речовини в залежності від наявності або не наявності хімічного зв'язку між власними атомами, існують у двох варіантах:
- Хімічні сполуки — хімічні речовини, структурні одиниці (молекули або інші формульні одиниці (якщо сполука немолекулярна)) яких складаються з атомів сполучених між собою певним типом хімічного зв'язку. За звичайних умов майже всі прості речовини (окрім благородних газів) є хімічними сполуками.
- Одноатомні гази — гази, що являють собою прості речовини, структурними одиницями для яких є не пов'язані хімічним зв'язком атоми. За звичайних умов їхніми представниками є благородні гази. Також за певних умов (наприклад при достатньому нагріванні) будь-який хімічний елемент може бути одноатомним газом.
Агрегатний стан
Всі прості речовини за звичайних умов знаходяться у певному для себе агрегатному стані:
- у газоподібному (тобто є газами) знаходяться прості речовини для 11 елементів (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn);
- у рідкому (тобто є рідинами) — для 2 (Br, Hg) (також слід зауважити що за кімнатної температури (або близької до неї) рідинами стають: Fr (27 °C), Cs (28 °C), Ga (30 °C), Rb (39 °C));
- у твердотільному (тобто є твердими тілами) — всі інші.
Алотропія
Узагальнити
Перспектива
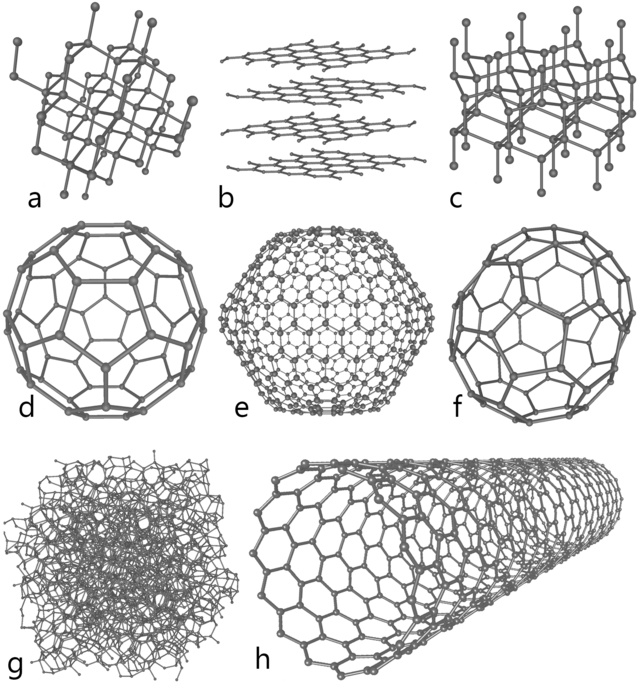
Прості речовини одного й того хімічного елементу, що різняться структурними одиницями (за будовою), а як наслідок і за властивостями, є алотропними модифікаціями цього ж хімічного елементу. Здатність деяких хімічних елементів існувати у вигляді двох або більше простих речовин називається алотропією.
Явище алотропії може бути обумовлено або різним складом молекул цих простих речовин даного елемента (алотропія складу), або різною будовою молекул і способом розміщення молекул (атомів) в кристалах простої речовини (алотропія форми)[2]. Різні алотропні модифікації одного хімічного елемента можуть переходити одна в одну. Для кожного хімічного елемента його алотропні модифікації завжди розрізняються по фізичним властивостям та хімічній активності (так, озон активніше кисню, а температура плавлення алмаза більше, ніж у фулеренів).
| Прості речовини деяких елементів, яким властиве явище алотропії | |
|---|---|
| Хімічний елемент | Прості речовини та їх назви |
| Карбон | графіт, алмаз, фулерени |
| Оксиген | кисень O2, озон O3 |
| Сульфур | сірка ромбічна, сірка моноклінна S8, сірка пластична |
| Фосфор | білий фосфор P4, червоний фосфор, чорний фосфор |
Найменування
Узагальнити
Перспектива
Назви простих речовин майже в усіх випадках збігаються з назвами відповідних хімічних елементів. Проте через те що деякі елементи утворюють по декілька простих речовин, назви останніх можуть відрізнятись від назв відповідних хімічних елементів (або не повністю відповідати їм). В такому випадку назви алотропних видозмін зазвичай утворюються з назв елементів і відповідних їм прикметників, наприклад: білий фосфор, червоний фосфор, аморфний вуглець, і т.д. Тільки для алотропних модифікацій кисню та вуглецю існують власні назви — озон, графіт, алмаз, карбін, фулерен.
Структура простої речовини позначається хімічною формулою. Так для кисню вона є O2, озону — O3, білого фосфору — P4, тощо. Для простих речовин немолекулярної будови число атомів у формулі не зазначається, тобто хімічна формула таких речовин за написанням збігається з символом хімічного елемента. Так, формула аргону — Ar, заліза — Fe, кремнію — Si, графіту та алмаза — C, міді — Cu, алюмінію — Al, тощо.
Номер CAS
Усім хімічним речовинам, а, отже і всім простим речовинам, описаним у науковій літературі, присвоюється номер CAS, хімічної реферативної служби, за яким речовину можна ідентифікувати в базах даних, наприклад у PubChem.
Порівняння понять
Узагальнити
Перспектива
У зв'язку з тим, що назви хімічних елементів і простих речовин здебільшого збігаються, поняття «атом», «хімічний елемент» та «проста речовина» не слід змішувати:
- «Атом» — конкретне поняття, бо являє собою частинку що існує реально;
- «Хімічний елемент» — збірне, абстрактне поняття, бо лише класифікує певну сукупність атомів;
- «Проста речовина» — форма, в якій хімічний елемент (певна сукупність атомів) у вільному (непов'язаному з іншими елементами) вигляді існує в природі.
Також потрібно розрізняти властивості (характеристики) простої речовини (сукупності частинок) та властивості (характеристики) хімічного елемента (ізольованого атома певного виду) (див. таблицю нижче).
| Порівняння характеристик хімічного елемента та простої речовини | |
|---|---|
| Хімічний елемент | Проста речовина |
| Атомний номер | Забарвлення |
| Атомна маса | Запах |
| Ізотопний склад | Електропровідність |
| Ізотопна поширеність | Теплопровідність |
| Будова атома | Розчинність |
| Енергія іонізації | Температура кипіння |
| Спорідненість до електрона | Температура плавлення |
| Електронегативність | В'язкість |
| Ступені окиснення | Твердість |
| Валентність | Оптичні властивості |
| Алотропні модифікації | Магнітні властивості |
| Хімічний знак | Хімічна формула |
| … | … |
Мінерали-прості речовини

Деякі прості речовини можуть самостійно утворювати окремі мінерали, які називають гомоатомними. Вони складаються з атомів лише одного елемента й можуть існувати в алотропних видозмінах та характеризуються головним чином або атомними структурами з металічним типом зв'язку (самородні метали), або молекулярними кристалічними ґратками (самородні неметали або металоїди). На їх частку припадає не більше 0,1% земної кори, але деякі з них відносно досить поширені й мають велике значення, наприклад, платина самородна, золото самородне, сірка самородна, алмаз та інші.
Цікаві факти
Вже в давнину були відомі прості речовини 13 елементів — Au, Ag, Cu, Hg, Pb, Fe, Sn, Pt, S, С, Zn, Sb та As[3].
Див. також
Примітки
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


