திமீத்ரி இவனோவிச் மெண்டெலீவ் (Dimitri Mendeleev) [2] (/ˌmɛndəlˈeɪəf/;[3] உருசியம்: Дми́трий Ива́нович Менделе́ев, பஒஅ: [ˈdmʲitrʲɪj ɪˈvanəvʲɪtɕ mʲɪndʲɪˈlʲejɪf](![]() கேட்க); 8 பெப்ரவரி 1834 – 2 பெப்ரவரி 1907 O.S. 27 ஜனவரி 1834 – 20 ஜனவரி 1907) ஒரு உருசிய வேதியியலாளரும் கண்டுபிடிப்பாளரும் ஆவார். இவர் வேதியியல் தனிமங்களை அவற்றின் பண்புகளின் அடிப்படையில் வரிசைப்படுத்த முயன்று, தனிமங்களின் அணு நிறைகளை அடிப்படையாகக் கொண்டு முதலாவது ஆவர்த்தன அட்டவணையை உருவாக்கினார்.[4] அவரது காலத்தில் கண்டுபிடிக்கப்படாத தனிமங்களின் இயல்புகளை மென்டெலீவ் வரையறுத்தவர் என்பது குறிப்பிடத்தக்க சாதனையாகும்.
கேட்க); 8 பெப்ரவரி 1834 – 2 பெப்ரவரி 1907 O.S. 27 ஜனவரி 1834 – 20 ஜனவரி 1907) ஒரு உருசிய வேதியியலாளரும் கண்டுபிடிப்பாளரும் ஆவார். இவர் வேதியியல் தனிமங்களை அவற்றின் பண்புகளின் அடிப்படையில் வரிசைப்படுத்த முயன்று, தனிமங்களின் அணு நிறைகளை அடிப்படையாகக் கொண்டு முதலாவது ஆவர்த்தன அட்டவணையை உருவாக்கினார்.[4] அவரது காலத்தில் கண்டுபிடிக்கப்படாத தனிமங்களின் இயல்புகளை மென்டெலீவ் வரையறுத்தவர் என்பது குறிப்பிடத்தக்க சாதனையாகும்.
| திமீத்ரி மெண்டெலீவ் | |
|---|---|
 | |
| பிறப்பு | திமீத்ரி இவனோவிச் மெண்டெலீவ் (Dmitri Ivanovich Mendeleev) 8 பெப்ரவரி 1834 வெர்க்நீ அரீம்சயானி, உருசியப் பேரரசு |
| இறப்பு | 2 பெப்ரவரி 1907 (அகவை 72) புனித பீட்டர்ஸ் பேர்க் |
| தேசியம் | உருசியன் |
| துறை | வேதியியல், பௌதிகவியல் |
| கல்வி கற்ற இடங்கள் | புனித பீட்டர்ஸ்பர்க் பல்கலைக்கழகம் |
| Academic advisors | குசுத்தாவ் கிர்க்காஃப் [1] |
| குறிப்பிடத்தக்க மாணவர்கள் | டிமிட்ரி பெட்ரோவிச் கொனொவலோவ் (Dmitri Petrovich Konovalov), வலெரி கெமிலியன் (Valery Gemilian), அலெக்ஸாண்டர் பேகோவ் (Alexander Baykov) |
| அறியப்படுவது | தனிம அட்டவணையை உருவாக்கியமை. |
| விருதுகள் | |
| துணைவர் | ஃபெயோஸ்வா நிகிடிச்னா லெஷ்செவா (Feozva Nikitichna Leshcheva) (1862–1871), அன்னா இவானொவா பொபொவா (Anna Ivanova Popova) (1882) |
| கையொப்பம் | |

வாழ்க்கைக் குறிப்பு
தீமீத்ரி மென்டெலீவ் ரஷ்யாவின் சைபீரியாவில் தோபோல்ஸ்க் என்ற இடத்தில் பெப்ரவரி 8, 1834 இல் இவான் பவ்லோவிச் மென்டெலீவ் மற்றும் மரீயா திமீத்ரியெவ்னா மென்டெலீவா என்பவருக்கும் 17ஆவது கடைசி மகவாகப் பிறந்தார். 13ஆவது வயதில் இவரது தந்தை காலமானார். தாயாரின் தொழிற்சாலை தீயில் எரிந்து அழிந்தது. வறுமையில் வாடிய மென்டெலீவின் குடும்பம் 1849 ஆம் ஆண்டில் சென் பீட்டர்ஸ்பேர்க் நகருக்கு இடம்பெயர்ந்தது. அங்கு 1850ம் ஆண்டில் திமீத்ரி ஆசிரியர் பயிற்சிக் கல்லூரியில் சேர்ந்து படித்துப் பட்டம் பெற்றார். அப்போது மெண்டெலீவுக்கு காசநோய் பீடித்ததால் 1855 இல் கருங்கடல் பகுதியில் உள்ள கிரிமியாவுக்குச் செல்ல வேண்டியதாகிவிட்டது. முற்றாக நோய் குணமானதும் மீண்டும் 1857 இல் சென் பீட்டர்ஸ்பேர்க் திரும்பினார்.
ஆய்வுப் பட்டமும் பரிசும்
1859 க்கும் 1861க்கும் இடையில் இவர் ஜெர்மனியின் ஹைடெல்பூர்க் நகரில் வேதியியல் ஆய்வுகளில் ஈடுபட்டார். 1861 இல் நிறமாலைமானி (spectroscope) பற்றிய ஒரு நூலை எழுதி வெளியிட்டர்.[5] இந்த நூல் இவருக்கு பீட்டர்ஸ்பர்க் அறிவியல் அகாடமியின் டெமிடோவ் (Demidov) பரிசைப் பெற்றுத்தந்தது.[5] இது அவருக்குப் பெரும் புகழைத் தேடிக் கொடுத்தது. 1862 இல் மெண்டெலீவ் சென் பீட்டர்ஸ்பேர்க் அரசு தொழில்நுட்பக் கல்லூரியில் வேதியியல் பேராசிரியரானார். 1863 இல் சென் பீட்டர்ஸ்பேர்க் அரச பல்கலைக்கழகத்தில் பேராசிரியரானார். 1865 இல் நீருடன் ஆல்கஹால் சேர்க்கை குறித்த ஆய்வுக்காக முனைவர் பட்டம் பெற்றார்.
ஆவர்த்தன அட்டவணை
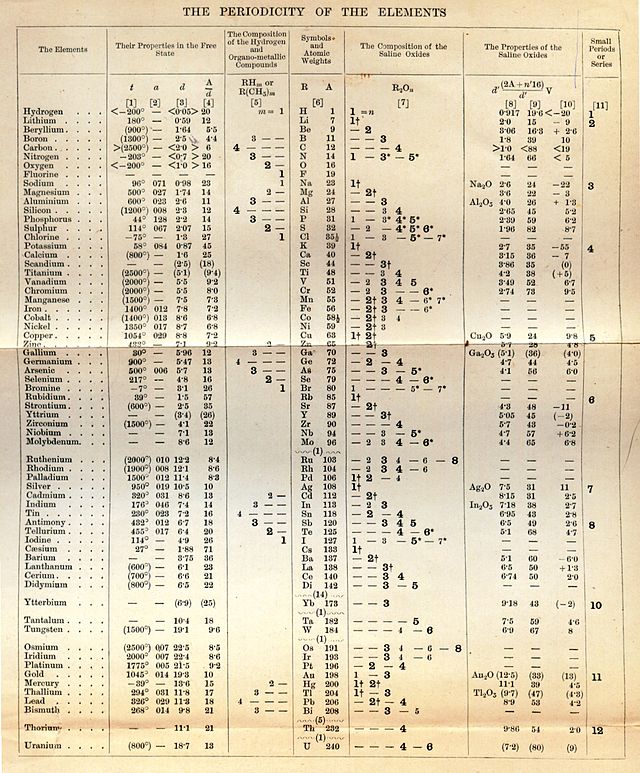
1863 ஆம் ஆண்டில் 56 தனிமங்கள் அறியப்பட்டிருந்தன. அக்காலத்தில் ஏறத்தாழ ஆண்டுக்கு ஒன்று என்ற விகிதத்தில் தனிமங்கள் கண்டுபிடிக்கப்பட்டன. மற்ற விஞ்ஞானிகள் முன்பு மூலக்க்கூறுகள் பற்றிய வரையறைகளையும், தனிமங்களின் ஆவர்த்தன பண்புகள் பற்றியும் அறிந்திருந்தனர்.
நியூலாண்டின் எண்ம விதி
1864 இல் ஜான் நியூலாண்ட்ஸ் (John Newlands) என்பவர் அணு எடைகளின் அடிப்படையில் எட்டு தனிமங்களாக தொகுக்கும்போது ஏற்படும் பண்பொற்றுமையைக் கருத்தில் கொண்டு எண்ம விதியை விவரித்தார். இதனை 1865ல் நியூலாண்டின் எண்ம விதி என்ற பெயரில் வெளியிட்டார். இதன் அடிப்படையில் ஜெர்மானியம் போன்ற புதிய தனிமங்கள் அடையாளம் காணப்பட்டன. 1887 வரை அவரது கண்டுபிடிப்புகள் வேதியியல் சங்கத்தால் அங்கீகரிக்கப்படாமல் விமர்சிக்கப்பட்டு வந்தன.
லொத்தர் மேயரின் ஆவர்த்தன பண்புகள்
1864 ஆம் ஆண்டு லொத்தர் மேயர் (Lothar Meyer) என்பவர், 28 தனிமங்களின் இணைதிறன்களை அடிப்படையாகக் கொண்டு தனிமங்களின் ஆவர்த்தன பண்புகள் பற்றிய ஒரு கருத்துத்தாளை முன்மொழிந்தார். ஆனால் அதில் புதிய தனிமங்கள் பற்றிய கணிப்புகள் எதுவும் இல்லை.
ஆவர்த்தனப் பண்புகளும் அட்டவணையும்
மென்டெலீவ் ஆசிரியரான பின்னர் மாணவர்களுக்காக இரண்டு பகுப்புகள் உடைய 'வேதியியலின் தத்துவங்கள்' (1868-1870) என்ற நூலை எழுதினார். அதனை அவர் தனது பாடத்திட்டத்திற்கான ஒரு பாடநூலாக்கிக்கொண்டார்.[5] இந்நூல் இவர் தன்னுடைய மிக முக்கியமான கண்டுபிடிப்பைச் செய்த போது எழுதப்பட்டதாகும்.[5] இவர் வேதியியல் குணங்களின் அடிப்படையில் தனிமங்களை வகைப்படுத்த முயன்றபோது, ஆவர்த்தனப் பண்புகளை முன்னிறுத்திய ஆவர்த்தன அட்டவணை எனும் கருத்து தோன்றியது. அணுத்திணிவு குறித்த பல தகவல்கள் கிடைத்தபோது அவர் தனக்கென ஒரு தனிம வரிசை அட்டவணையைத் தயாரித்தார். அனைத்து தனிமங்களுடன் கூடிய அந்த அட்டவணையை அவர் கனவில் முழுமையாகக் கண்டதாகக் கூறியிருந்தார்.[6][7][8][9][10]
"நான் கண்ட கனவில் , எல்லா தனிமங்களும் அவற்றிற்கு உரிய தேவைப்படும் இடத்தில் இருக்கும் ஒரு அட்டவணையைப் பார்த்தேன். உடனடியாக எழுந்து, ஒரு காகிதத்தில் அதை எழுதினேன். அவசியம் என்று தோன்றிய ஒரே இடத்தில் ஒரு திருத்தம் செய்தேன்."[11][12]
-இன்ஸ்டான்ட்ஸேவ் என்பாரின் கூற்றுப்படி திமீத்ரி இவனோவிச் மெண்டெலீவ் கூறியவை
1860 களில் ஆவர்த்தன அட்டவணை தயாரிப்புக்கான முந்தைய வேலைகளைப் பற்றி அறியாமல், பின்வரும் அட்டவணையை அவர் தயார் செய்தார்:
| Cl35.5 | K39 | Ca40 |
| Br80 | Rb85 | Sr88 |
| I127 | Cs133 | Ba137 |
இந்த முறையில் வேறு தனிமங்களைச் சேர்த்தபோது நீள்வரிசை ஆவர்த்தன அட்டவணை உருவானது.[13][14] மார்ச் 6, 1869 இல் மெண்டெலீவ் ரஷ்ய வேதியியல் கழகத்தில் தான் தயாரித்த அட்டவணையை 'தனிமங்களின் பண்புகள் அவற்றின் அணு எடைகளைச் சார்ந்திருக்கின்றன' என்ற தலைப்பில் சமர்ப்பித்தார். அணு எடை மற்றும் இணைதிறன் ஆகிய இரண்டும் தனிமங்களின் பண்புகளை விளக்கும் கூறுகள் என்றும் அதில் விவரித்திருந்தார்.[15][16] இந்த அட்டவணையில் அப்போது பல கண்டிபிடிக்கப்படாத தனிமங்களின் இயல்புகளையும் எதிர்வு கூறி அட்டவணையை முழுமைப்படுத்தியிருந்தார். மென்டெலீவ் இவ்வட்டவணையை வெளிப்படுத்திய சில மாதங்களுக்குப் பின்னர் ஜெர்மனியின் ஜூலியஸ் மேயர் என்பவர் அதே மாதிரியான அட்டவணையை அறிவித்தார்.
- தனிமங்கள், அவற்றின் அணு எடைகளின்படி எறுவரிசையில் அமைக்கப்படுமானால் அவற்றின் பண்புகள் ஆவர்த்தன அடிப்படையில் இருப்பது வெளிப்படும்.
- ஒரே மாதிரியான வேதி குணங்களைக் கொண்ட தனிமங்கள், ஒரே மாதிரியான அணு நிறைகளைப் பெற்றிருக்கும் (உதாரணம்: பிளாட்டினம், இரிடியம், ஆஸ்மியம்) அல்லது அவற்றின் அணு எடைகள் எறுவரிசையில் அமைந்திருக்கும் (உதாரணம்: பொட்டாசியம், ருபீடியம், சீஸியம்).
- அணுவின் எடையின் வரிசையில் ஒரு தொடரில் உள்ள தனிமங்களின் இணைதிறன்கள் அவற்றின் அணு எடைகளைப்பொறுத்து மாறுபடும். அதேபோல், குறிப்பிடத்தக்க அளவிற்கு, அவற்றின் தனித்துவமான இரசாயன பண்புகளுடன் ஒத்திருக்கும். இதனை லித்தியம், பெரிலியம், போரான், கார்பன், நைட்ரஜன், ஆக்ஸிஜன் மற்றும் புளூரின் என்ற தொடரில் வெளிப்படையாகக் காணலாம்.
- குறைந்த அணு எடைகள் கொண்ட தனிமங்கள், மிகவும் எளிதாகப் பரவக்கூடியவை.
- ஒரு பொருளின் தன்மையை மூலக்கூறுகள் தீர்மானிப்பது போல், அணு எடை தனிமங்களின், பண்புகளை நிர்ணயிக்கிறது.
- பல அறியப்படாத தனிமங்கள் கண்டுபிடிக்கப்படுவதை நாம் எதிர்பார்க்க வேண்டும் (உதாரணம்: இரு தனிமங்கள்: அலுமினியத்திற்கும் சிலிக்கானுக்கும் ஒப்பானவை அவற்றின் அணு நிறைகள் 60 முதல் 75 வரை இருக்கும்).
- தனிமங்களின் அணு எடைகள், சில நேரங்களில் அவற்றிற்கு அடுத்துள்ள தனிமங்கள் பற்றிய அறிவால் திருத்தப்படலாம். டெல்லுரியத்தின் அணு எடை 123 மற்றும் 126 க்கு இடையில் இருக்க வேண்டும், 128 ஆக இருக்கக்கூடாது. (டெலூரியத்தின் அணு நிறை 127.6 ஆகும், மேலும் மெண்டலீவ் ஒரு தொடரில், அணு எடையானது சீராக அதிகரிக்க வேண்டும் என்று கருதினார்)
- தனிமங்களின் சில சிறப்பியல்பு பண்புகள் அவற்றின் அணு நிறைகளைக் கொண்டு முன்னறிவிக்கப்படலாம்
திமீத்ரி மெண்டெலீவ் அறியப்பட்ட அனைத்து தனிமங்களின் ஆவர்த்தன அட்டவணையை ஒரு ரஷ்ய மொழி அறிவியல் ஆய்வுப் பத்திரிகையில் வெளியிட்டார். அட்டவணையை நிறைவு செய்யக்கூடிய பல புதிய தனிமங்களை முன்னறிவித்தார். ஒரு சில மாதங்களுக்குப் பிறகு, மேயர் என்பார், ஏறத்தாழ இதே போன்ற அட்டவணையை ஜேர்மனிய மொழி அறிவியல் ஆய்வுப் பத்திரிகையில் வெளியிட்டார்.[17][18] சிலர் மேயர் மற்றும் மெண்டலீவ் ஆகியோரை ஆவர்த்தன அட்டவணையின் இணை-படைப்பாளர்களாக கருதுகின்றனர். மெண்டலீவ் தன் அட்டவணைப்படி, ஜெர்மானியம், கேலியம் மற்றும் ஸ்கந்தியம் ஆகியவற்றின் பண்புகளை அடிப்படையாகக் கொண்டு, எகாசிலிங்கன், எகாளுமைனியம் மற்றும் ஈகோபரோன் என்ற கண்டுபிடிக்கப்படாத தனிமங்களின் குணங்களைத் துல்லியமாக கணித்துள்ளார்.
அவரது கணிப்பில் தோன்றிய எட்டு தனிமங்களுக்கு, பெயரிடும்போது, எகா, டை, மற்றும் ட்ரை (சமஸ்கிருத மொழியில் ஒன்று, இரண்டு, மூன்று) எனும் முன்னொட்டுகளைப் பயன்படுத்தினார். மெண்டலீவ் தன் காலத்தில் ஏற்றுக்கொள்ளப்பட்ட தனிமங்களின் அணு எடைகளில் சிலவற்றைப் பற்றி கேள்விகளை எழுப்பினார் (அந்தக் காலத்தில் குறைந்த அளவிலான துல்லியத்தோடு மட்டுமே அணு எடைகளை அளக்க முடிந்தது). அவரது கால வரையறையால் பரிந்துரைக்கப்பட்ட ஆவர்த்தன விதியை அவை ஒத்திருக்கவில்லை என்று சுட்டிக்காட்டினார். டெலூரியம் அயோடைனை விட அதிக அணு எடையைக் கொண்டிருப்பதாக அவர் குறிப்பிட்டார். மேலும், அவர் அவற்றை சரியான வரிசையில் வைத்தார். அந்த நேரத்தில் ஏற்றுக்கொள்ளப்பட்ட அணு எடைகள் தவறு என்று கணிக்கப்பட்டன. அறியப்பட்ட லந்தானைகளுக்கு எங்கே இடம் அளிப்பது என்பது பற்றி அவர் குழப்பமடைந்தார். மேலும் அணு நிறையில் மிகுந்த ஆக்டினைடுகள் இதே அட்டவணையில் மற்றொரு வரிசையில் இருப்பதைக் கணித்தார். மேலும் பல தனிமங்கள் இருப்பதாக மெண்டலீவ் கணித்தவற்றை சிலர் புறந்தள்ளினர்.
ஆனால் 1875 மற்றும் 1886 ஆம் ஆண்டுகளில் Ga (கேலியம்) மற்றும் Ge (ஜெர்மானியம்) ஆகியவை முறையே காலியாக விடப்பட்டிருந்த இடைவெளிகளில் குறிப்பிட்டிருந்த பண்புகளுடன் பொருந்தி இருந்ததை அவர் நிரூபித்தார்.[19]
அவரது கொள்கைப்படி "கண்டுபிடிக்கப்படாத தனிமங்கள்" பட்டியலிலிருந்த தனிமங்களுக்கு சமஸ்கிருதப் பெயர்களை அளித்ததன் மூலம், மெண்டலீவ் பண்டைய இந்தியாவின் சமஸ்கிருத இலக்கண அறிஞர்களுக்குத் தனது பாராட்டுதல்களையும் நன்றியுணர்வையும் வெளிப்படுத்தினார். அவரது இச்செயல், மொழியின் அதிநவீன கோட்பாடுகளான அடிப்படை ஒலிகளிலுள்ள இரு பரிமாண வடிவங்களை கண்டுபிடித்த இலக்கண அறிஞர்களுக்கு நன்றி செலுத்தும் விதமாக அமைந்தது. மெண்டலீவ் சமஸ்கிருதவாத பௌத்லிங்க்(Böhtlingk)கின் நண்பர் ஆவார். அந்த நேரத்தில் பௌத்லிங்க் தனது பானினி (Pāṇini)[20] என்ற புத்தகத்தின் இரண்டாவது பதிப்பைத் தயாரித்துக்கொண்டிருந்தார். மெண்டலீவ் தனிமங்களுக்கான பெயரிடும் முறையில் இவற்றை புகுத்துவதின் மூலம் பௌத்லிங்க்கை கௌரவிக்க விரும்பினார்.[21]
பானினி இலக்கணத்தில் அறிமுகமான சிவா(Śiva) மற்றும் சுத்ரா(Sūtras)வுக்கும், தனிம வரிசை அட்டவணைக்கும் இடையே உள்ள ஒற்றுமைகளைக் குறித்து பேராசிரியர் கிபார்ஸ்கி(Prof. Kiparsky) பின்வருமாறு கூறுகிறார்:
ஒற்றுமைகள்
இரண்டு அமைப்புகளுக்கும் இடையே உள்ள ஒப்புமைகள் சிறப்பானவை: மொழியில் உள்ள ஒலிகளைத் தெளிவாக உச்சரிப்பதற்குரிய ஆதாரங்கள், ஒலிவடுவ அமைப்புகள் ஆகியவை ஒலியியல் முறைமை பண்புகளின் செயல்பாடு ஆகும் என பாணினி கண்டறிந்தார். அதைப்போல, தனிமங்களின் வேதிப் பண்புகள் அவற்றின் அணு எடையின் செயல்பாடாகும் என்று மெண்டலீவ் கண்டுபிடித்தார்.
பாணினி ஒலியியல் ஒப்புமை முறைமையைக் கண்டறிந்தது போலவே, மெண்டெலீவ் தனிமங்களின் "இலக்கணம்" [அவர் சமவுருவுடைமை (isomorphism) கொள்கையைப்பயன்படுத்தி, சாத்தியமான வேதிச் சேர்மங்களை உருவாக்குவதற்கு பொது சூத்திரங்களைப் பார்ப்பதன் மூலம்] கண்டுபிடித்தார்.
ஒலிவள சிக்கலின் அதிகரிப்பிற்கு ஏற்ப (எ.கா., எளிய ஸ்டாப் க்கள், எ.கா .. மற்ற ஸ்டோப்புகளுக்கு முன்பாகவும், மற்றும் கியூ, பியூ போன்ற வெளிப்பாடுகளில் அவை அனைத்தையும் குறிக்கும்) பாணினி ஒலிக்குறிகளை வரிசைப்படுத்தினார். அது போல மெண்டலீவ், அணு நிறைகளின் ஏறு வரிசையில் தனிமங்களை ஒழுங்கமைத்தார். முதல் வரிசையில் "வழக்கமான அல்லது பிரதிநிதித்துவ தனிமங்கள்" (உதாரணம்: ஆக்சிஜன், நைட்ரஜன், கார்பன் முதலியன) இடம் பெற்றன.
ஒலிப்பு முறைமைகளின் அமைப்பில் எளிமை தேவைப்பட்டதால், பாணினி, ஒலிகளின் இணை ஒற்றுமையை சிதைத்து வகைப்படுத்தினார். (உதாரணம்: அடிநாக்கு உயர்ந்து மேலண்ணத்தின் மென்மையான தொண்டைப் பக்கத்தில் தொட்டு எழும்பும் ஒலிகள், இதழின ஒலிகள்,[ப, ம போன்றவை], மூக்கொலிகள் எனப்படும் மெல்லினம்)
தனிமங்கள் அணு எடையால் முரண்பட்டபோது, மெண்டலீவைப் பொறுத்தவரையில் சமவுருவுடைமைக்கு முன்னுரிமை அளித்தார். (உதாரணம்: அணு எடை அடிப்படையில், நைட்ரஜன் மற்றும் பாஸ்பரஸ் தனிமங்களுடன் ஒத்திருந்தாலும், மெக்னீசியம் தனிமமானது அதன் பண்புகளின் அடிப்படையில் பெரிலியம் குடும்பத்தில் இடம் அமர்த்தப்பட்டுள்ளது). இரண்டு நிலைகளிலும் இவர்களின் ஆவர்த்தன பண்புக் கண்டுபிடிப்புகள் பிற்காலத்தில் உள் கட்டமைப்பு கோட்பாட்டால் விளக்கப்பட்டன.[22]"
மெண்டலீவ் கண்டுபிடித்து உருவாக்கிய அசல் வரைவு பல ஆண்டுகளுக்கு பின்னர் தனிமங்களின் தற்காலிக அமைப்புமுறை என்ற பெயரில் புத்தகமாக வெளியிடப்பட்டது.[23]
டிமிட்ரி மெண்டலீவ் தனிமவரிசை அட்டவணையின் தந்தை என்று குறிப்பிடப்படுகிறார். இவர் தன்னுடைய வரிசைகளிலும் பத்திகளிலும் தகவல் தரும் கருவியமைப்பு அல்லது அட்டவணையை ஆவர்த்தன அமைப்பு என்று குறிப்பிடுகிறார்.[24]
மேற்கோள்கள்
வெளி இணைப்புகள்
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
