கால்சியம் அசிட்டேட்டு
From Wikipedia, the free encyclopedia
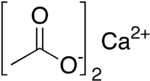
கால்சியம் அசிட்டேட்டு (Calcium acetate) என்பது Ca(C2H3O2)2. என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட அசிட்டிக் அமிலத்தின் (CH3COOH) கால்சியம் உப்பாகும். இதனுடைய முறைப்படியான பெயர் கால்சியம் எத்தனோயேட்டு என்றாலும் இது கால்சியம் அசிட்டேட்டு என்ற பொதுப் பெயராலேயே வழங்கப்படுகிறது. முற்காலத்தில் சுண்ண அசிட்டேட்டு என்ற பழைய பெயராலும் அழைக்கப்பட்டது. நீரிலி வடிவ கால்சியம் அசிட்டேட்டின் நீர் உறிஞ்சும் தன்மை மிகவும் அதிகம் என்பதால் ஒற்றை நீரேற்று வடிவமே (Ca(CH3COO)2•H2O) நீரிலியாக கொள்ளப்படுகிறது.
 | |
 Calcium acetate crystals | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
கால்சியம் அசிட்டேட்டு | |
| வேறு பெயர்கள்
சுண்ண அசிட்டேட்டு கால்சியம் எத்தனோயேட்டு கால்சியம் ஈரசிட்டேட்டு | |
| இனங்காட்டிகள் | |
| 62-54-4 5743-26-0 (ஒரு நீரேற்று) | |
| Abbreviations | Ca(OAc)2 |
| ATC code | A12AA12 (நீரிலி) |
| ChEBI | CHEBI:3310 |
| ChEMBL | ChEMBL1200800 |
| ChemSpider | 5890 |
| DrugBank | DB00258 |
| EC number | 269-613-0 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 6116 |
| வே.ந.வி.ப எண் | AF7525000 |
| |
| UNII | Y882YXF34X |
| பண்புகள் | |
| C4H6CaO4 | |
| வாய்ப்பாட்டு எடை | 158.17 g·mol−1 |
| தோற்றம் | வெண்மையான திண்மம் நீர் உறிஞ்சும் |
| மணம் | இலேசான அசிட்டிக் அமில மணம் |
| அடர்த்தி | 1.509 கி/செ.மீ3 |
| உருகுநிலை | 160 °C (320 °F; 433 K)[1] CaCO3 + அசிட்டோனாக சிதைவடைகிறது |
| 37.4 கி/100 மி.லி (0 °செ) 34.7 கி/100 மி.லி (20 °செ) 29.7 கி/100 மி.லி (100 °செ) | |
| கரைதிறன் | மெத்தனால், ஐதரசீன் ஆகியனவற்றில் சிறிதளவு கரையும் அசிட்டோன், எத்தனால் மற்றும் பென்சீன் ஆகியனவற்றில் கரையாது |
| காடித்தன்மை எண் (pKa) | 6.3-9.6 |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.55 |
| தீங்குகள் | |
Autoignition temperature |
680 முதல் 730 °C (1,256 முதல் 1,346 °F; 953 முதல் 1,003 K) |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
4280 மி.கி/கி.கி (வாய்வழி, எலி) |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
பொதுவான கார்பனேட்டு பாறைகள் அல்லது சுண்ணாம்புக்கல் அல்லது மார்பிள் அல்லது முட்டை ஓடுகளில் உள்ள கால்சியம் கார்பனேட்டை ஊற வைத்து அல்லது நீர்த்த சுண்ணாம்பை வினீகரில் ஊற வைத்து கால்சியம் அசிட்டேட்டு தயாரிக்கலாம்.
- CaCO3(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + H2O(l) + CO2(g)
- Ca(OH)2(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + 2H2O(l)
இரண்டு வினைப்பொருட்களும் பண்டைக்காலத்தில் இருந்தே கிடைக்கப் பெறுகிறது என்றாலும் இவை படிகவடிவ வேதிப்பொருட்கள் எனப் பின்னரே அறியப்பட்டன.
பயன்கள்
• சிறுநீரக நோயால் பாதிக்கப்பட்டவர்களின் இரத்தத்தில் பாசுபேட்டு அளவு அதிகரிக்கும் போது எலும்புகள் பாதிப்படைகின்றன. கால்சியம் அசிட்டேட்டு உணவிலுள்ள பாசுபேட்டை பிணைத்து இரத்த பாசுபேட் அளவைக் கட்டுபடுத்துகிறது.
• உணவுக் கூட்டுப்பொருளாக, நிலைநிறுத்தியாக, இடைத்தாங்கலாக உலோக அயனியாக E263 என்ற குறியீட்டுப் பெயருடன் குறிப்பாக இனிப்புகளில் பயன்படுத்தப்படுகிறது. தண்ணீர் கலந்த புளோரைடையும் இது நடுநிலையாக்குகிறது[2].
• மலிவாகக் கிடைக்கும் என்பதால் கமீன் செயல்முறை வளர்ச்சியடையும் வரையிலும் அசிட்டோனை தொகுப்பு முறையில் தயாரிக்க இதுவே மூலப்பொருளாக எடுத்துக் கொள்ளப்பட்டது:[3][4] .
- Ca(CH3COO)2 → CaCO3(s) + (CH3)2CO(v)
• ஆல்ககாலில் கரைக்கப்பட்ட கால்சியம் அசிட்டேட்டின் நிறைவுற்ற கரைசல் அரை திண்ம நிலையில் உள்ள எரிதகு கூழ்ம ஆல்ககாலாக உருவாகிறது[5] . • கால்சியம் அசிட்டேட்டை எத்தனாலுடன் கலந்தால் வெண்மையான கூழ்ம பனித்திறள் போல உருவாகும்[6]. வகுப்பறைகளில் வேதியியல் ஆசிரியர்கள் இதைப் பனிப்பந்து என உருவாக்கி விளக்குவர்.
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
