வேதிச் சேர்மம் From Wikipedia, the free encyclopedia
சிர்கோனியம் (IV) குளோரைடு, சிர்கோனியம் டெட்ராகுளோரைடு என்றும் அழைக்கப்படுகிறது, (ZrCl4) என்பது ஒரு கனிமச் சேர்மம் ஆகும், இது சிர்கோனியத்தின் பிற சேர்மங்களுக்கு முன்னோடியாக அடிக்கடி பயன்படுத்தப்படுகிறது. இந்த வெண்ணிறமான, உயர் உருகுநிலையைக் கொண்ட திண்மமானது ஈரப்பதமான காற்றில் விரைவாக நீராற்பகுப்பு அடைகிறது.
 | |
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
சிர்கோனியம் டெட்ராகுளோரைடு சிர்கோனியம்(IV) குளோரைடு | |
| இனங்காட்டிகள் | |
| 10026-11-6 | |
| ChEBI | CHEBI:77566 |
| ChemSpider | 23202 |
| EC number | 233-058-2 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24817 |
| |
| UNII | Z88176T871 |
| பண்புகள் | |
| ZrCl4 | |
| வாய்ப்பாட்டு எடை | 233.04 கி/மோல் |
| தோற்றம் | வெண்ணிறப் படிகங்கள் நீர் உறிஞ்சும் திறன் |
| அடர்த்தி | 2.80 g/cm3 |
| உருகுநிலை | 437 °C (819 °F; 710 K) (முப்புள்ளி) |
| கொதிநிலை | 331 °C (628 °F; 604 K) (பதங்கமாகிறது) |
| hydrolysis | |
| கரைதிறன் | அடர் ஐதரோகுளோரிக் காடி (வினையுடன்) |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சாய்வு, mP10 |
| புறவெளித் தொகுதி | P12/c1, No. 13 |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−980.52 கிஜுல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
181.41 ஜுல் கெல்வின்−1 மோல்−1 |
| வெப்பக் கொண்மை, C | 125.38 ஜுல் கெல்வின்−1 மோல்−1 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | MSDS |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாதது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
1688 மிகி/கிகி (வாய்வழி, எலி) 655 mg/kg (mouse, oral)[1] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சிர்கோனியம் டெட்ராபுளோரைடு சிர்க்கோனியம்(IV) புரோமைடு சிர்க்கோனியம்(IV) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | தைட்டானியம் டெட்ராகுளோரைடு ஆப்னியம் டெட்ராகுளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
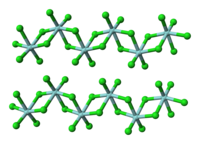
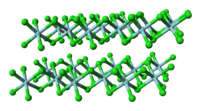
TiCl 4 மூலக்கூறு போலல்லாமல், திட ZrCl 4 ஒரு பலபடிக் கட்டமைப்பை ஏற்கிறது, இதில் ஒவ்வொரு Zr அணுவும் அறுமுகி வடிவில் அணைவுக்குள்ளாகியுள்ளது. கட்டமைப்பில் காணப்படும் இந்த வேறுபாடு அவற்றின் பண்புகளில் உள்ள வேறுபாடுகளுக்குக் கரணமாய் அமைந்துள்ளது. TiCl
4 வாலைவடித்தலுக்குட்படக்கூடியது, ஆனால் ZrCl
4 ஒரு திண்மமாக உள்ளது. திட நிலையில், ZrCl 4 ஒரு நாடா போன்ற நேர்கோட்டு பலபடி கட்டமைப்பைப் பெறுகிறது. (HfCl<sub id="mwFg">4</sub> ஆல் ஏற்றுக்கொள்ளப்பட்ட அதே அமைப்பு). இந்தப் பலபடி லூயிஸ் காரங்களுடனான வினையின் போது எளிதில் சிறிய மூலக்கூறாகச் சிதைவுறுகிறது. இது Zr-Cl-Zr பிணைப்புகளை உடைக்கிறது.[3]
இந்த மாற்றம் கார்பனுடனான ஆக்சைடின் வினையை ஒரு ஆக்சைடைப் பெறும் வினை என்ற அளவிற்கு இன்றியமையாததாக ஆக்குகிறது.
ஒரு ஆய்வக அளவிலான செயல்முறையானது கார்பன் மற்றும் குளோரின் ஆகியவற்றிற்கு பதிலாக கார்பன் டெட்ராக்ளோரைடைப் பயன்படுத்துகிறது:[4]
ZrCl4 என்பது கிரோல் செயல்முறையின்படி சிர்கோனியம் தாதுக்களை உலோக சிர்கோனியமாக மாற்றுவதற்கான வினையில் ஒரு இடைநிலைப் பொருள் ஆகும். இயற்கையில், சிர்கோனியம் தாதுக்கள் பெரும்பாலும் ஆக்சைடுகளாக இருக்கின்றன (அனைத்து சிர்கோனியம் குளோரைடுகளும் நீராற்பகுப்படைவவதற்கான போக்கால் இவ்வாறு அமைகின்றன). முழுவதும் உலோகமாக மாற்றுவதற்காக, இந்த வெப்பந்தாங்கவல்ல ஆக்சைடுகள் முதலில் டெட்ராக்ளோரைடாக மாற்றப்பட்டு பின்னர் அவை அதிக வெப்பநிலையில் வாலைவடிக்கப்படுகின்றன. சுத்திகரிக்கப்பட்ட ZrCl 4 ஐ Zr உலோகத்துடன் குறைத்து சிர்கோனியம் (III) குளோரைடை உற்பத்தி செய்யலாம்.
சிர்கோனியம் டை ஆக்சைடு மற்றும் சிர்கோனியம் டைபோரைடு ஆகியவற்றின் வேதி ஆவிப் படிவுக்கான பொதுவான முன்னோடி ZrCl 4 ஆகும்.[5]
கரிமத் தொகுப்பு வினைகளில் ஒன்றான பிரீடல்-கிராப்ட்சு வினை, டையல்சு-ஆல்டர் வினை மற்றும் மூலக்கூறிடை படிகமாக்கல் வினை போன்ற வினைகளில் சிர்கோனியம் டெட்ராக்ளோரைடு வலிமை குறைந்த லூயிசு அமிலமாகப் பயன்படுகிறது.[6] அல்காக்சைடுகள் மற்றும் சிர்கோசீன் போன்ற சிர்கோனியத்தின் பல கரிம வழிப்பொருள்களின் தொகுப்பில் தொடக்க வினைப்பொருளாகும். சிலிகான் நெகிழி படச்சுருள்களைப் பதப்படுத்துவதில் அல்காக்சைடுகள் மதிப்புடையவை என நிரூபிக்கப்பட்டுள்ளது. துணி மற்றும் இழைப் பொருட்களின் தயாரிப்பில் நீர் விலக்கும் தன்மையை உருவாக்க இது பயன்படுகிறது. இது பயனுள்ள, செயற்கையான, இடைநிலைப் பொருள்களைத் தயாரிப்பதற்கும், இயற்கை பொருட்கள் தொகுப்பின் முக்கிய படிகளில் பயன்படுத்துவதற்கும் ஒரு திறன்வாய்ந்த, நிலைத்தன்மை உடைய, மலிவான, சுற்றுச்சூழலுக்கு உகந்த மற்றும் வசதியான வினையூக்கியாகும்.[7]
ZrCl 4 இன் நீராற்பகுப்பு சிர்கோனைல் குளோரைடு எனப்படும் நீரேற்றப்பட்ட ஐதராக்சி குளோரைடு கொத்தணியைத் தருகிறது. இந்த வினையானது மிக விரைவானதாகவும் மற்றும் மீள்வினைக்கான வாய்ப்பற்றதுமாக இருக்கிறது.
நீருடன் அதிவேகமாக வினைபுரிந்து ஐதரோகுளோரிக் காடியை அதிக வெப்ப உமிழ்வுடன் தருகிறது. ஈரப்பதமான சூழ்நிலையில் உலோகங்களை அரிக்கும் தன்மை உடையது.
இச்சேர்மம் (ZrCl4) இதன் பலபடி அமைப்பின் காரணமாக, வழக்கமாக இதன் பயன்பாட்டிற்கு முன்னதாக ஒரு மூலக்கூறு அணைவாக மாற்றிக்கொள்ளப்படுகிறது. இது டெட்ராஐதரோபியூரானுடன் 1:2 அணைவ உருவாக்குகிறது.[8] NaC5H5 ZrCl4(THF)2 உடன் வினைபுரிந்து சிர்கோனோசீன் டைகுளோரைடைத் (ZrCl2(C5H5)2), ஒரு பல்தன்மையுள்ள கரிம சிர்கோனியம் அணைவுச் சேர்மத்தைத் தருகிறது.[9]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.