ஆண்டிமணி பென்டாபுளோரைடு (Antimony pentafluoride) ஒரு SbF5 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய ஒரு கனிமச் சேர்மம் ஆகும். இது ஒரு நிறமற்ற, பாகுநிலையுடைய, மதிப்புமிக்க லுாயிசு அமிலமாகும். மேலும் இது, அறியப்பட்டுள்ள அமிலங்களுள் வலிமைமிக்க அமிலமான புளோரோ ஆண்டிமணிக் அமிலம் எனும் மீவீரிய அமிலத்தின் பகுதிப்பொருளாகவும் உள்ளது. இது தனது லுாயிசு அமிலத்தன்மைக்காகவும் எல்லா சேர்மங்களுடன் வினைபுரியும் தன்மைக்காகவும் நன்கறியப்பட்டதாக உள்ளது.[3]
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
ஆண்டிமணி (V) புளோரைடு | |||
| வேறு பெயர்கள்
ஆண்டிமணிபென்டாபுளோரைடு பென்டாபுளோரிடோஆண்டிமணி | |||
| இனங்காட்டிகள் | |||
| 7783-70-2 | |||
| ChemSpider | 22963 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24557 | ||
| வே.ந.வி.ப எண் | CC5800000 | ||
| |||
| UN number | 1732 | ||
| பண்புகள் | |||
| SbF5 | |||
| வாய்ப்பாட்டு எடை | 216.74 கி/மோல் | ||
| தோற்றம் | நிறமற்ற எண்ணெய் போன்ற திரவம் நீர் உறிஞ்சும் தன்மை உடையது | ||
| மணம் | மூக்கைத்துளைக்கும் நெடி | ||
| அடர்த்தி | 2.99 கி/செமீ3 [1] | ||
| உருகுநிலை | 8.3 °C (46.9 °F; 281.4 K) | ||
| கொதிநிலை | 149.5 °C (301.1 °F; 422.6 K) | ||
| வினைபுரிகிறது | |||
| கரைதிறன் | பொட்டாசியம் புளோரைடில் கரையும், திரவ SO2 கரையும் | ||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0220 | ||
| ஈயூ வகைப்பாடு | தீங்குவிளைவிக்கக்கூடியது (Xn) சுற்றுச்சூழலுக்கு ஆபத்தானது (N) | ||
| R-சொற்றொடர்கள் | R20/22, R51/53 | ||
| S-சொற்றொடர்கள் | (S2), S61 | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு |
TWA 0.5 மிகி/மீ3 (Sbயைப் போல)[2] | ||
பரிந்துரைக்கப்பட்ட வரம்பு |
TWA 0.5 மிகி/மீ3 (Sbயைப் போல)[2] | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | ஆண்டிமணி பெண்டாகுளோரைடு | ||
| ஏனைய நேர் மின்அயனிகள் | பாசுபரசு பென்டாபுளோரைடு ஆர்செனிக் பென்டாபுளோரைடு பிசுமத் பென்டாபுளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
ஆண்டிமனி பென்டாபுளோரைடானது ஆண்டிமணி ஐங்குளோரைடுடன் நீரற்ற ஐதரசன் புளோரைடை வினைப்படுத்துவதன் மூலம் கிடைக்கிறது.[4]
- SbCl5 + 5 HF → SbF5 + 5 HCl
இச்சேர்மமானது ஆண்டிமணி டிரைபுளோரைடுடன் புளோரினை வினைப்படுத்தியும் தயாரிக்கப்படலாம். [5]
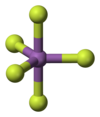
வாயு நிலையில், SbF5, D3h புள்ளி சமச்சீர்மைத் தொகுப்பைச் சார்ந்த ஒரு முக்கோண இரட்டைப் பட்டைக்கூம்பு வடிவத்தை ஏற்கிறது. இச்சேர்மம் திரவ மற்றும் திண்ம நிலைகளில் மிகவும் சிக்கலான அமைப்புகளைப் பெறுகிறது. திரவ நிலையில் Sb அணுக்கள் ஒவ்வொன்றும் எண்முகி அமைப்பைக் கொண்ட பலபடிகளைக் கொண்டவையாகவும், இந்த அமைப்பானது [SbF4(μ-F)2]n ((μ-F) என்ற வாய்ப்பாட்டாலும் குறிக்கப்படுகிறது. ((μ-F) என்பது, இரண்டு Sb மையங்களுக்கு பாலமாக புளோரைடு மையங்கள் விளங்குவதைக் குறிக்கிறது). படிக நிலையில் உள்ள சேர்மமானது டெட்ராமெராக (நான்குபடி மூலக்கூறாக), [SbF4(μ-F)]4 என்ற மூலக்கூறு வாய்ப்பாட்டை உடையதாக உள்ளது. Sb-F பிணைப்புகள் Sb4F4 வளையத்தில் 2.02 Å பிணைப்பு நீளத்தை உடையதாகவும்; நான்கு Sb மையங்களிலிருந்து புறப்படும் மற்ற நான்கு புளோரைடு ஈனிகள் 1.82 Å. நீளத்துடன் குறைவான பிணைப்பு நீளம் கொண்டவையாகவும் உள்ளன.[6] இச்சேர்மத்தை ஒத்த மற்ற சேர்மங்களான PF5 மற்றும் AsF5 ஆகியவை மைய அணுக்களின் சிறிய அளவின் காரணமாக தத்தமது ஈதல் அணைவு எண்ணை குறைவான ஒன்றாக வரையறுத்துக் கொள்ளும் காரணத்தால், திண்ம மற்றும் திரவ நிலைகளில் ஒற்றை மூலக்கூறாக (ஒருமமாக) காணப்படுகிறது. BiF5 மூலக்கூறானது ஒரு பலபடியாக உள்ளது.[7]
இதே வழிமுறையின்படி SbF5 ஆனது, HF -இன் பிரான்சுடெட் அமிலத்தன்மையை அதிகரிக்கிறது. இது F2 ஆக்சிசனேற்றும் சக்தியை அதிகப்படுத்துகிறது. இந்த விளைவானது, ஆக்சிசனின் ஆக்சிசனேற்ற வினையினால் விளக்கப்படுகிறது.[8]
- 2 SbF5 + F2 + 2 O2 → 2 [O
2]+
[SbF
6]−
முதன்முதலில் கண்டறியப்பட்ட புளோரினின் சேர்மங்களிலிருந்து புளோரின் வாயுவை உற்பத்தி செய்த வேதிவினையிலேயே ஆண்டிமணி ஐம்புளோரைடானது பயன்படுத்தப்பட்டுள்ளது:
- 4 SbF
5 + 2 K
2MnF
6 → 4 KSbF
6 + 2 MnF
3 + F
2
இந்த வினைக்கான இயக்கு சக்தியாக, F− அயனியின் மீதான SbF5 -இன் அதிக நாட்டம் அமைகிறது. இந்தப் பண்பே SbF5 இன் பயன்பாட்டை மீவலிமை மிக்க அமிலங்கள் தயாரிப்பதற்கு பரிந்துரைக்கக் காரணமாக அமைகின்றன.
எக்சாபுளோரோஆண்டிமணேட்டு
SbF5ஆனது F− அயனிகளைத் தரும் மூலங்களிடம் ஒரு வலிமையான லுாயிசு அமிலமாக செயல்பட்டு, மிகவலிமையான எதிர் மின் அயனியான எக்சாபுளோரோஆண்டிமணேட்டு என்றழைக்கப்படுகின்ற [SbF6]− அயனியைத் தருகிறது. எக்சாபுளோரோபாசுபேட்டுடன் PF6− ஒப்பிடும் போது [SbF6]− ஒரு வலிமை குறைவான ஈந்திணைவு எதிரயனியாக உள்ளது. .
இந்த அயனியானது மிகவும் வலிமை குறைந்த காரமாக இருப்பினும், [SbF6]− கூடுதல் SbF5 உடன் வினைபுரிந்து மையச்சீர்மைகொண்ட சேர்க்கை விளைபொருளைத் தருகிறது:
- SbF5 + [SbF6]− → [Sb2F11]−
SbF5 பல சேர்மங்களுடன் தீவிரமான வினையில் ஈடுபட்டு ஐதரசன் புளோரைடு என்ற ஆபத்தை விளைவிக்கும் பொருளை வெளிவிடுகிறது. இச்சேர்மம் தோல் மற்றும் கண்களை அரிக்கும் தன்மையுடையது.[9][10]
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.