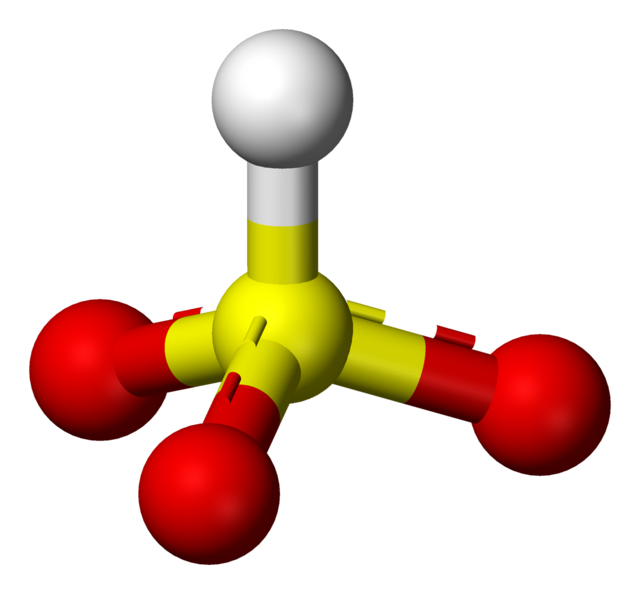
Vätesulfit, äldre benämning bisulfit, betecknar salter som innehåller vätesulfitjonen HSO3-, exempelvis natriumvätesulfit, NaHSO3.

Egenskaper
Svavelsyrlighet (H2SO3) bildas vid lösning av svaveldioxid i vatten,[2]
- SO2(g) + H2O ⇌ H2SO3 (aq),
och genom protolys fås sedan vätesulfitjoner
Vätesulfitjonen står i sin tur i jämvikt med sulfitjonen:
- HSO3- + H2O ⇌ SO32- + H3O+.
I dessa lösningar finns även sulfitjonens dimer, disulfitjonen S2O52-
Vätesulfitjonen är en svag syra, pKa för HSO3- + H2O ⇌ SO32- + H3O+ är 6,97. pKa för svavelsyrlighet H2SO3 + H2O ⇌ HSO3- + H3O+ är 1,81.
Vätesulfiter är, liksom svaveldioxid och sulfiter, reduktionsmedel (svavel med oxidationstalet +IV oxideras lätt till +VI).
Framställning
Vätesulfiter framställs vanligen genom en reaktion mellan svaveldioxid och alkaliska vattenlösningar (av hydroxider eller karbonater), eftersom jämvikten SO2(g) + 2 H2O ⇌ HSO3- + H3O+ är starkt förskjuten åt vänster. Sålunda OH- + SO2 ⇌ HSO3-, exempelvis "NaOH + SO2 → NaHSO3".[3]
Användning
Genom att värma upp trä i en lösning av vätesulfit (även sulfit eller disulfit) löses ligninet upp och cellulosan kvarstår. Detta användes vid den så kallade sulfitprocessen för pappersframställning.
Eftersom vätesulfiter är reduktionsmedel används de också som tillsats till adrenalin (epinephrin) och noradrenalin (norepinephrin) för att förhindra oxidation.[5]
Referenser
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
