Ugljenikov oksid
From Wikipedia, the free encyclopedia
Remove ads
Remove ads
Oksougljenik ili ugljenikov oksid je hemijsko jedinjenje koje sadrži samo ugljenik i kiseonik.[1][2]
Najjednostavniji i najčešći oksougljenici su ugljen-monoksid (CO) i ugljen-dioksid (CO2). Poznati su mnogi drugi stabilni ili metastabilni oksidi ugljenika, mada se oni ređe sreću, npr. ugljen suboksid (C3O2 or O=C=C=C=O) i melitik anhidrid (C12O9).
 | |||||||
| CO Ugljen monoksid |
CO2 Ugljen dioksid |
C3O2 Ugljen suboksid |
C12O9 Melitik anhidrid |
Dok udžbenici obično navode samo prva tri, i retko četvrti, veliki broj drugih oksida je poznat. Većina njih je sintetisana nakon 1960-tih. Neki od tih novih oksida su stabilni na sobnoj temperaturi. Neki su metastabilni ili stabilni samo na veoma niskim temperaturama, ali se razlažu u jednostavnije oksougljenike pri zagrevanju. Mnogi su suštinski nestabilni i mogu se uočiti samo trenutno kao intermedijeri u hemijskim reakcijama ili su u toj meri reaktivni da mogu da postoje samo u gasovitoj fazi ili pod uslovima matrične izolacije.
Broj poznatih oksougljenika stalno raste. Postojanje grafenskih oksida i drugih stabilnih polimernih ugljenikovih oksida sa nevezanim molekulskim strukturama[3][4] sugeriše da postoji mnoštvo neotkrivenih oksida.
Remove ads
Pregled
Ugljen-dioksid (CO2) je široko zastupljen u prirodi, i ljudi su ga generisali od praistorijskih vremena putem sagorevanja supstanci koje sadrže ugljenik, kao i fermentacijom hrane kao što su pivo i hleb. On je vremenom prepoznat kao hemijska supstanca, koju su hemičari u 17. i 18. veku nazivali („šumski duh“) ili „fiksirani vazduh“.
Ugljen-monoksid se isto tako može formirati sagorevanjem, i korišten je (mada nije bio prepoznat) od antičkih vremena za topljenje gvožđa iz ruda. Poput-dioksida, njega su razni alhemičari i hemičari opisali i studirali na Zapadu još od Srednjeg veka. Njegov sastav je otkrio Vilijam Kruikšank 1800. godine.
Ugljen suboksid je otkrio Brodi 1873. godine, propuštajući električnu struju kroz ugljen-dioksid.[5]
Četvrti "klasični" oksid, melitik anhidrid (C12O9), su pripremili Libig i Veler 1830. godine u njihovoj studiji melita, ali su ga okarakterisali tek 1913 Mejer i Stejner.[6][7][8]
Brodi je takođe otkrio 1859. godine peto jedinjenje zvano grafitni oksid, koje sadrži samo ugljenik i kiseonik u varirajućim odnosima između 2:1 i 3:1; ali su priroda i molekulska struktura te supstance ostali nepoznati do nedavno, kad je preimenovano u grafenski oksid i postalo je predmet istraživanja u nanotehnologiji.[3]
Značajni primeri nestabilnih ili metastabilnih oksida koji su detektovani samo u ekstremnim situacijama su diugljen-monoksidni radikal (:C=C=O), ugljen trioksid (CO3),[9] ugljen tetroksid (CO
4),[10][11] ugljen pentoksid (CO
5),[12] ugljen heksoksid (CO
6)[13] i 1,2-dioksetandion (C2O4).[14][15] Neki od tih reaktivnih ugljenikovih oksida su otkriveni u molekularnim oblacima u intrastelarnom medijumu pomoću rotacione spektroskopije.[16]
Mnogi hipotetični oksougljenici su studirani teoretskim metodama, ali do sada nisu detektovani. Primeri takvih jedinjenja su oksalni anhidrid (C2O3 ili O=(C2O)=O), etilen dion (C2O2 ili O=C=C=O)[17] i drugi linearni ili ciklični polimeri ugljen-monoksida (-CO-)n (poliketoni),[18] i linearni ili ciklični polimeri ugljen-dioksida (-CO2-)n, kao što je dimer 1,3-dioksetandion (C2O4)[19] i trimer 1,3,5-trioksantrion (C3O6).[19][20]
 |
 |
 |
|||||||
| C2O3 Oksalni anhidrid |
C2O4 1,2-Dioksetan- dion |
C2O4 1,3-Dioksetan- dion |
C3O6 1,3,5-Trioksan- trion |
C2O2 Etilen dion |
Remove ads
Opšta struktura
Normalno je ugljenik tetravalentan, dok je kiseonik divalentan, i u većini oksougljenika (kao i u većini drugih jedinjenja kiseonika) svaki atom ugljenika može da bude vezan za četiri druga atoma, dok kiseonik može da bude vezan za najviše dva. Dok ugljenik može da bude vezan za druge ugljenike i da formira proizvoljno duge lance ili mreže, lanci sa tri ili više atoma kiseonika su retki, ako se ikad i sreću. Poznati električno neutralni ugljenikovi oksidi se generalno sastoje od skeletona sa jednim ili više ugljenika (uključujući ciklične i aromatične strukture) sa vezanim oksidnim (-O-, =O) ili peroksidnim (-O-O-) grupama.
Atomi ugljenika sa nezasićenim vezama su prisutni u nekim oksidima, kao što je diradikal C2O ili :C=C=O; mada su takva jedinjenja generalno suviše reaktivna da bi se izolovala.[21] Gubitak ili zadobijanje elektrona može da dovede do monovalentnog negativnog kiseonika (-O−
), trovalentnog pozitivnog kiseonika (≡O+
), ili trovalentnog negativnog ugljenika (≡C−
). Zadnja dva se nalaze u ugljen-monoksidu, −C≡O+.[22] Negativni kiseonik se javlja u većini oksougljeničnih anjona.
Remove ads
Linearni ugljenični-dioksidi
Jedna familija ugljenikovih oksida ima opštu formulu CnO2, ili O=(C=)nO — naime, linearni lanac ugljenikovih atoma, sa kiseoničnim kapama na oba kraja. Prvi članovi su
- CO2 ili O=C=O, dobro poznati ugljen-dioksid.
- C2O2 ili O=C=C=O, ekstremno nestabilan etilen dion.[17]
- C3O2 ili O=C=C=C=O, metastabilni ugljen suboksid ili triugljenik-dioksid.
- C4O2 ili O=C=C=C=C=O, tetraugljen-dioksid ili 1,2,3-butatrien-1,4-dion[23]
- C5O2 ili O=C=C=C=C=C=O, pentaugljen-dioksid,[24] koji je stabilan u rastvoru na sobnoj temperaturi i u čistom stanju do −90 °C.[25]
Neki viši članovi ove familije su detektovani u tragovima u gasnoj fazi i/ili kriogenim matričnim eksperimentima, specifično za n = 7[25]:p.97 and n = 17, 19, i 21.[26]:p.95
Linearni ugljen-monoksidi
Još jedna familija ugljenikovih oksida su linearni ugljen-monoksidi CnO. Prvi član, obični ugljen-monoksid CO, je jedino jedinjenje ove grupe koje je stabilno u čistom stanju na sobnoj temperaturi. Fotoliza linearnih ugljen-dioksida u kriogenoj matrici dovodi do gubitka CO, čime se formiraju merljive količine neparnih-monoksida kao što su C2O, C4O,[21] i C6O.[25] Članovi do n=9 se isto tako formiraju električnim pražnjenjem u gasovitom C3O2 rastvorenom u argonu.[27] Prva tri člana familije su detektovana u interstelarnom prostoru.[27]
Kad je n neparano, smatra se da su molekuli u tripletnom (kumulenu sličnom) stanju, gde su atomi povezani dvostrukim vezama i postoji jedna nepopunjena orbitala na prvom ugljeniku — kao u :C=C=O, :C=C=C=C=O, i generalno, :(C=)n=O. Kad je n parno, smatra se da tripletna struktura rezonuje sa singletnim (acetilenskim tipom) polarnog stanja sa negativnim naelektrisanjem na ugljeničnom kraju i pozitivnim na kiseoničnom kraju, kao u −C≡C-C≡O+, −C≡C-C≡C-C≡O+, i generalno, −(C≡C-)(n-1)/2C≡O+.[27] Sam ugljen-monoksid sledi ovaj obrazac: smatra se da je njegova predominantna forma −C≡O+.[22]
Remove ads
Ciklični poliketoni radialenskog tipa
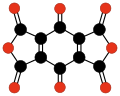
Još jedna familija oksougljenika koja je privukla specijalnu pažnju su ciklični ugljenikovi oksidi radialenskog tipa CnOn ili (CO)n.[28] Oni se mogu smatrati cikličnim polimerima ugljen-monoksida, ili n-tostrukim ketonima n-ugljeničnih cikloalkana. Sam ugljen-monoksid (CO) se može smatrati prvim članom. Teoretske studije indiciraju da etilen dion (C2O2 ili O=C=C=O) i ciklopropantrion C3O3 ne postoje.[17][18] Sledeća tri člana — C4O4, C5O5, i C6O6 — su teoretski moguća, ali se očekuje da su sasvim nestabilna,[18] i do sada su bili sintetisani samo u tragovima.[29][30]
 |
 |
 |
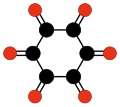 | ||||||
| (CO)2 Etilen dion |
(CO)3 Ciklopropan- trion |
(CO)4 Ciklobutan- tetron |
(CO)5 Ciklopentan- penton |
(CO)6 Cikloheksan hekson |
S druge strane, anjoni tih oksougljenika su sasvim stabilni, i neki od njih su bili poznati od 19. veka.[28] Oni su
- C2O22−, acetilendiolat (Ves i Bihner, 1963),[31]
- C3O32−, deltat (Egerding i Vest, 1976),[32][33]
- C4O42−, skvarat (Kohen i drugi, 1959),[34]
- C5O52−, krokonat (Gmelin, 1825),[35] and
- C6O62−, rodizonat (Heler, 1837).[36][37]
Ciklični oksid C6O6 takođe formira stabilne anjone tetrahidroksi-1,4-benzohinon (C6O64−) i benzenheksol (C6O66−).[38] Aromatičnost tih anjona je izučavana koristeći teoretske metode.[39][40]
Remove ads
Novi oksidi
Mnogi novi stabilni ili metastabilni oksidi su bili sintetisani nakon 1960-tih, kao što su:
- C10O8, benzohinontetrakarboksilni dianhidrid (Hamond, 1963).[41]
- C6O6, etilentetrakarboksilni dianhidrid, stabilni izomer cikloheksanheksona (Sauer i drugi, 1967).[42]
- C12O12 ili C6(C2O4)3, heksahidroksibenzen trisoksalat (Verter i Dominic, 1967); stabilan kao tetrahidrofuranski rastvor.[43]
- C10O10 ili C6O2(C2O4)2, tetrahidroksi-1,4-benzohinon bisoksalat (Verter i drugi, 1968); stabilan u vidu tetrahidrofuranskog rastvora.[44]
- C8O8 ili C6O2(CO3)2, tetrahidroksi-1,4-benzohinon biskarbonat (Nalajah, 1984); razlaže se na oko 45–53 °C.[45]
- C9O9 ili C6(CO3)3, heksahidroksibenzen triskarbonat (Nalajah, 1984); razlaže se na oko 45–53 °C.[45]
- C24O6, ciklični trimer biradikala 3,4-dialkinil-3-ciklobuten1,2-diona -C≡C-(C4O2)-C≡C- (Rubin i drugi, 1990);[46]
- C32O8, tetramer 3,4-dialkinil-3-ciklobuten1,2-diona (Rubin i drugi, 1990);[46]
- C4O6, dioksan tetraketon ili dimerni oksalni anhidrid (Strazolini i drugi, 1998); stabilan u Et2O na −30 °C, razlaže se na 0 °C.[47]
- C12O6, heksaoksotriciklobutabenzen (Hamura i drugi, 2006)[48][49]
Mnogi srodnici ovih oksida su istraživani teoretskim metodima, i od nekih se očekuje da su stabilni, kao što su drugi karbonatni i oksalatni estri tetrahidroksi-1,2-benzohinona i rodizonske, krokonske, skvarinske, i deltinske kiseline.[18]
Remove ads
Polimerni ugljenični oksidi
Ugljen suboksid se spontano polimerizuje na sobnoj temperaturi u ugljeno-kiseonični polimer, sa atomskim odnosom ugljenik:kiseonik 3:2. Za ovaj polimer se smatra da je linearni lanac vezan sa šestočlanim laktonskim prstenovima, koji ima neprekidnu ugljeničnu osnovu od naizmeničnih jednostrukih i dvostrukih veza. Fizička merenja indiciraju da je prosečan broj jedinica po molekulu oko 5–6, u zavisnosti od temperature formiranja.[4][50]
 |
 | ||||||||
| Terminirajuće i ponavljajuće jedinice polimernog C3O2.[4] | |||||||||
 |
 |
 |
 | ||||||
| Oligomeri C3O2 sa 3 do 6 jedinice.[4] | |||||||||
Ugljen-monoksid kompresovan do 5 GPa u ćeliji dijamantskog nakovnja proizvodi donekle sličan crvenkasti polimer sa nešto višim kiseoničnim sadržajem, koji je metastabilan na sobnim uslovima. Smatra se da dolazi do CO disproporcionacije u ćeliji do smeše CO2 i C3O2, i da C3O2 formira polimer koji je sličan sa gore opisanim (mada ima iregularniju strukturu), koja delom zarobljava CO2 u svojoj matrici.[51][52]
Još jedan ugljeno-kiseonični polimer, sa C:O odnosom 5:1 ili višim, je klasični grafitni oksid[3] i njegova jednoravanska verzija je grafenski oksid.
Remove ads
Vidi još
- Oksougljenični anjon
- Pseudo-oksougljenični anjon
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads