U hemiji, slobodni par je par valentnih elektrona bez hemijske veze, To su elektroni koje atom ne deli sa drugim atomima. Oni su locirani na spoljašnjem elektronskom sloju atoma, tako da su slobodni parovi podskup molekulskih valentnih elektrona. Oni se mogu identifikovati pregledom spoljašnjeg energijskog nivoa atoma. Slobodni elektronski parovi se sastoje od parova elektrona za razliku od pojedinačnih elektrona, koji se javljaju u nepopunjenim atomskim orbitalama. Ukupni broj valentnih elektrona jedinjenja je zbir broja slobodnih parova i broja vezujućih elektrona.[1][2]
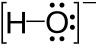
Primeri

Jedan slobodni pare se može naći na atomima azotnih grupa kao što je azot u amonijaku, a dva slobodna para se mogu naći na atomima u halkogenih grupa kao što je kiseonik u vodi. Halogeni mogu da imaju tri slobodna para, npr. u hlorovodoničnoj kiselini.
U jednostavnoj elektronskoj teoriji valence atom kiseonika u vodi je 3 hibridizovan sa slobodnim parovima u 3 orbitalama. Ugao veze je 104.5°, što je manje od 109° za pravilni tetraedarski ugao. To se može objasniti repulzivnim interakcijama između slobodnih parova.[3][4][5]
Vidi još
Reference
Literatura
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.