Базе или лужине (grč. βάση, basé – основа, фундамент) је једна од основних категорија хемијских једињења.[1][2] Базе су у ужем смислу сва једињења, која у воденим растворима могу градити хидроксидне јоне (), те тако повисити вредност раствора. Хидроксилни јони су хемијска једињења која из киселина могу преузети протоне дајући молекуле воде. Стога је база на неки начин супротност киселинама те се с њима неутрализира. У ширем смислу, разни базно-киселински концепти описују далеко ширу палету хемијских реакција, који прелазе оквире особина хидроксидних јона у води. Од посебног значаја су концепти по Луису (Луисове базе и Луисове киселине),[3] те према Пеарсону, који наводи поделу на јаке и слабе киселине и базе.[4]

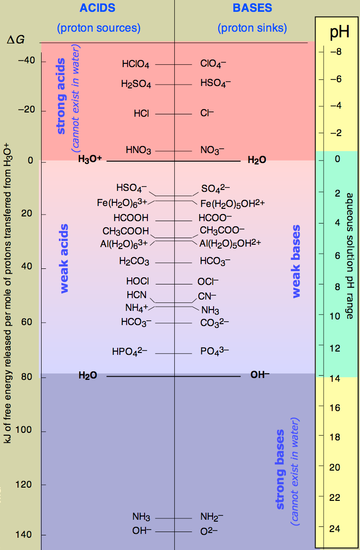
Већина база су супстанце које производе хидроксидне јоне (ОХ−) у воденим растворима, и стога се класификују као Аренијусове басе.[5] Да би супстанца била класификована као Аренијусова база, она мора да формира хидроксилне јоне у воденом раствору. Аренијус је сматрао да је неопходно да база садржи хидроксид у својој структури. Из тог разлога је Аренијусов модел ограничен, пошто се њиме не могу објаснити базна својства амонијака у воденом раствору (), као ни његових органских деривата (амина).[6] Исто тако постоје базе које не садрже хидроксидни јон, али ипак реагују с водом, што доводи до повећања концентрације хидроксидног јона.[7] Пример тога је реакција између амонијака и воде, чиме се формира амонијак и хидроксид.[7] У овој реакцији амонијак је база пошто он прима протон од молекула воде.[7] Амонијак и друге базе сличне њему обично имају способност формирања везе са протоном услед слободног електронског пара који поседују.[7] У општијој Бронстед-Лоријевој теорији киселина и база, база је супстанца која може да прими јоне водоника () — иначе познате као протони.

У води базе путем промене аутојонизационе[8] ravnoteže[9] производе растворе у којима је концентрација јона водоника нижа него у чистој води, нпр., вода има већи од 7,0 при стандардним условима. Растворне базе се називају алкалијама, ако садрже и квантитативно отпуштају јоне. Међутим, важно је да се нагласити да базност није исто што и алкалност. Метални оксиди, хидроксиди, и посебно алкоксиди су базни, и контрајони слабих киселина су јаке базе.
Базе се могу сматрати хемијском супротношћу киселина, мада неке киселине имају способност деловања као базе.[10] Базе и киселине се могу видети као супротни концепти зато што је дејство киселине да повећава концентрацију хидронијум јона () у води, док базе редукују његову концентрацију. Реакције између киселине и базе се називају неутрализацијом. У реакцији неутрализације, водени раствор базе реагује са воденим раствором киселине да произведе раствор воде и соли у коме је со раздвојена на њене јоне. Ако је водени раствор засићен датим соним растворком, свака додатна количина такве соли се таложи из раствора.[11]
Хемијски концепт појма базе је увео француски хемичар Гијом Франсоа Руел 1754. године.[12][13] Он је уочио да киселине, које су у то време биле углавном испарљиве течности (попут сирћетне киселине), прелазе у чврсте соли једино кад се комбинују са специфичним супстанцама. Роуелле је сматрао да такве супстанце служе као „база“ за соли, дајући соли „конкретну или чврсту форму“.[14]
Историјски развој појма
Током доба алхемије било је познато неколико алкалних једињења, попут кречњака (, и ), натрон, сода, поташа и амонијака. Све до почетка 18. века није била позната тачна разлика између соде и поташе. Појам алкалије се мање користио и није био познат тачан међусобни однос између ових супстанци. База (алкалија) као супротност киселини постулирана је у хемијатрији, медицинско-теоретском учењу које је заступао Ото Тахенијус у 17. веку.
Све до 18. века одржало се мишљење о тесној повезаности између база и ватре односно ватрене материје, а због њихових познатих егзотермичких реакција. Појам базе увели су хемичари из 17. века, попут Георг Ернст Стахла, Роберт Бојла и Гијом Франсоа Руела, јер су оне биле основне супстанце које су градиле неиспарљиву основу (базу) за фиксирање испарљивих киселина и уклањале (поништавале) њихове нагризајуће особине.
Темељни корак у хемији начинио је Антоан Лавоазје. Он је сматрао, да ће киселине увек настати из оксида неметала и воде, а базе од воде и оксида метала. Хамфри Дејви и Јустус фон Либиг су заступали мишљење да су киселине једињења водоника, који се помоћу метала могу превести у соли. Сванте Аренијус је 1887. дефинисао базе као супстанце, које се након њиховог растварања у води дисоцирају отпуштањем хидоксидног јона, те киселине као супстанце које се дисоцирају отпуштањем протона. Киселине и базе се међусобно неутрализирају. Међутим ова теорија је била мањкава, јер није обухватала једињења без кисеоника. Пример за то је амонијак који неутралише киселине.
Јоханес Николас Бринстед је 1923. представио свој базно-киселински модел. Његов модел се дуго времена одржао у хемији, нарочито у аналитичкој. Према његовој теорији, киселине и базе делују међусобно у реакцијама преноса протона, тако што их базе преузимају од киселина. Исте године, Гилберт Њутон Луис је такође представио свој модел који је помогао у објашњењу тока реакција у органској хемији и хемији комплекса, а његове дефиниције су примењиве и изван њих. Стога се данас може говорити о Луисовим базама и Луисовим киселинама. Према том моделу су многа једињења, која су до тада сматрана киселинама, "искључена" из киселина. Концепт слабих и јаких киселина и база развио је Ралф Пирсон 1963.[15] и тиме проширио начин посматрања реакција у органској хемији и хемији комплекса.
Врсте база
Одређена хемијска једињења се означавају као бази због својих посебних хемијских особина. Широк распон ових хемикалија се може поделити у групе према одређеним показатељима. Према њиховом јонском набоју, базе се могу поделити на неутралне, анјонске и катјонске базе. Амонијак () не носи јонски набој, те је према томе неутрална база. Пример анјонске базе је натријум-хидрогенкарбонат, јер он у раствору даје анјон . У анјонске базе такође се може сврстати и хидроксилни анјон ().
Други начин поделе база је њихова подела на једновалентне или двовалентне базе. Натријум-хидроксид () у раствору по једном јону натријума гради један јон те је стога једновалентан. С друге стране, калцијум-хидроксид () по једном јону гради два јона − те је он двовалентан.
Као градитељ база називају се једињења, код којих се поред базичних реакција одвијају и друге хемијске реакције. Таква једињења су метални оксиди, који при свом отапању у води с њом граде одговарајући хидроксид. Тако на пример калцијум-оксид () са водом гради базу . Неплеменити метали попут алкалних могу бити оксидирани деловањем воде. При врло бурној реакцији натријума с водом поред натријум-хидроксида (соде) настаје и водоник.
| Врста | пример | реакција |
|---|---|---|
| неутралне базе | амонијак () | |
| анјонске базе | натријум-хидрогенкарбонат () | |
| катјонске базе | у воденом раствору | |
| једновалентне базе | натријум-хидроксид () калијум-хидроксид () |
|
| двовалентне базе | калцијум-хидроксид () | |
| градитељи база | неплеменити метали, попут алкалних | |
| калцијум-оксид () баријум-оксид () |
||
Аренијусова теорија
По класичној, јонској теорији Аренијуса база је хемијско једињење, које у воденом раствору, услед дисоцијације издвајањем јона −, повећава њихову концентрацију, а смањује концентрацију + јона (повећава rаствора). Аренијусове базе су растворљиве у води и ови раствори увек имају већи од 7.
Пример Аренијусове базе:
Бронстедова теорија
Како ова теорија има ограничења, Јоханес Бронстед је дао теорију према којој је база акцептор протона (јона ).
Пример Бронстедове базе:
је база, јер је акцептор протона.
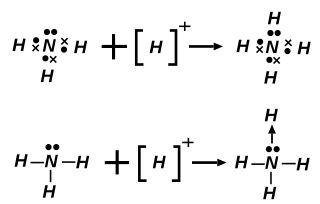
Протеолитичка теорија
По протолитичкој теорији, база је свако хемијско једињење које је акцептор (прималац) катјона водоника (), тј. протона, у условима дате реакције.
Нпр. у реакцији:
једињење је киселина, а једињење база.
Хемијска једињења (са изузетком неколико веома јаких киселина и база) могу у зависности од услова да врше улогу киселине или базе – оваква једињења се зову амфотерна једињења.
Луисова теорија
Најприхваћенију општу дефиницију базе дао је Г. Н. Луис: База је једињење, које је донор (давалац) електронског пара у условима дате хемијске реакције.
Пример Луисове базе:
У овом случају је киселина, а база јер атом кисеоника у молекулу донира слободан електронски пар, а атом сумпора прима тај електронски пар да би постигао стабилан октет.[16]
Особине
Махом су у чврстом агрегатном стању, лужинастог укуса (укус сапуна, пепела) дјелимично растворљиве у води. Општа својства база су:
- Концентроване или јаке базе су каустичне на органској материји и бурно реагују са киселим супстанцама.
- Водени раствори или растопљене базе се дисоцирају на јоне и проводе струју.
- Реакције са индикаторима: базе претварају црвени литмус папир у плаво, фенолфталеин у љубичасто, не мењају боју бромотимол плавог, и претварају метил оранж у жито.
- вредност базних раствора под стандардним условима је већа од седам.
- Базе имају горак укус.[17]
Реакције између база и воде
Следећа реакција представља општу реакцију између базе () и воде за формирање коњуговане киселине () и коњуговане базе ():[7]
Константа равнотеже, , ове реакције се може наћи користећи следећу општу једначину:[7]
У овој једначини се базе () и екстремно јаке базе (коњуговане базе) међусобно надмећу за протон.[18] Резултат тога је да базе које реагују са водом имају релативно малу вредност константе равнотеже.[18] База је слабија кад има нижу вредност константе равнотеже.[7]
Добијање база
Оксид метала + вода ----> база
Метал + вода ----> база
Неутрализација
Основе неутрализације су засноване на чињеници, да се карактеристике киселина при мешању са неком базу не употпуњавају него се поништавају. Тако на примјер нека база се са погодном количином неке киселине неутралише. У тој реакцији базе и киселине настаје вода.
Реакција натријум-хидроксида у и са водом даје "живу соду":
Реакција хлороводоника у и са водом даје хлороводичну киселину:
Реакција "живе соде" са хлороводичном киселином (неутрализација):
"Živa soda" + hlorovodična kiselina reagiraju dajući rastvor natrijum-hlorida u vodi.
Најважнији део овог процеса је реакција између хидроксид- и оксониј-јона:
Слабе базе, као што је сода бикарбона или беланце, се могу користити за неутрализацију просуте киселине. Неутрализација киселина јаким базама, као што је натријум хидроксид или калијум хидроксид може да узрокује силовите егзотермне реакције, и саме базе могу да узрокују штету која је слична просутој киселини.
Алкалност нехидроксида
Базе су генерално једињења која могу да неутралишу извесну количину киселине. Натријум карбонат и амонијак су базе, мада ни једна од тих супстанци не садржи OH−
групе. Оба једињења примају кад су растворена у протонским растварачима, као што је вода:
Полазећи од ових једначина, pH, или киселост, се могу израчунати за водене растворе база. Базе такође директно делују као донори електронских парова:
База се исто тако може дефинисати као молекул који има способност да прими електронски пар улазећи у валентну љуску другог атома.[10] Постоји ограничен број елемената чији атоми могу да формирају молекул са базним својствима.[10] Угљеник може да делује као база, као и азот и кисеоник. Флуор и понекад ретки гасови поседују ту способност, такође.[10] До тога типично долази у једињењима као што су бутил литијум, алкоксиди, и метални амиди, као што је натријум амид. Базе угљеника, азота и кисеоника без резонантне стабилизације су обично веома јаке, или супербазе, које не могу да постоје у воденом раствору услед киселости воде. Резонантна стабилизација, међутим, омогућава постојање слабијих база као што су карбоксилати; на пример, натријум ацетат је слаба база.
Јаке базе
Јака база је базно хемијско једињење које може да уклони протон (+) са (или депротонише) молекул веома слабе киселине у киселинско базној реакцији. Примери јаких база су хидроксиди алкалних и земноалкалних метала, нпр. и Ca(OH)
2. Услед њихове ниске растворљивости, неке базе, као што су земноалкални хидроксиди, се могу користити у околностима где се фактор растворљивости не узима у обзир.[19] Један од корисних аспеката њихове ниске растворљивости је да су „многи антациди суспензије металних хидроксида као што је алуминијум хидроксид и магнезијум хидроксид.“[20] Та једињења имају ниску растворљивост и способност заустављања повећања концентрације хидроксидних јона, чиме спречавају оштећења ткива уста, једњака, и желуца.[20] Путем дуготрајног прогреса реакције и растварања соли, стомачна киселина реагује са хидроксидом који је отпуштен из суспензије.[20] Веома јаке базе се скоро комплетно хидролизују у води, те долази до засићења.[10] У том процесу, молекули воде се комбинују са јаком базом, услед амфотерног карактера воде; и долази до отпуштања хидроксидног јона.[10] Веома јаке базе могу чак да депротонују и веома слабо киселе групе у одсуству воде. Примери јаких база су:
- Литијум хидроксид ()
- Натријум хидроксид ()
- Калијум хидроксид ()
- Рубидијум хидроксид ()
- Цезијум хидроксид ()
- Магнезијум хидроксид (Mg(OH)
2) - Стронцијум хидроксид (Sr(OH)
2) - Баријум хидроксид (Ba(OH)
2)
Катјони тих јаких база су елементи прве и друге групе периодног система (алкални и земноалкални метали).
Киселине са вредношћу већом од око 13 се сматрају веома слабим, и њихове коњуговане базе су јаке базе.
Јаке базе имају способност формирања стабилних једињења комбиновањем са јаким киселинама.[10] Слабе базе, међутим, немају способност формирања стабилних једињења комбиновањем са слабим киселинама.[10]
Супербазе
Соли карбањона, амиди и хидриди из групе 1 могу да буду још јаче базе услед екстремне слабости њихових коњугованих киселина, које су стабилни угљоводоници, амини, и диводоник. Обично се те базе креирају додавањем чистих алкалних метала као што је натријум у коњуговану киселину. Оне се називају супербазама, и не могу се формирати у воденим растворима зато што су јаче базе од хидроксидног јона. Као такве, оне депротонишу коњуговану киселину, воду. На пример, етоксидни јон (коњугована база етанола) у присуству воде подлеже следећој реакцији.
- CH
3CH
2O−
+ H
2O → CH
3CH
2OH + OH−
Примери супербаза су:
- Бутил литијум ()
- Литијум диизопропиламид (LDA)
- Литијум диетиламид (LDEA) (C
2H
5)
2NLi - Натријум амид ()
- Натријум хидрид ()
- Литијум бис(триметилсилил)амид [(CH
3)
3Si
2NLi
Неутралне базе
Кад неутрална база формира везу са неутралном киселином, долази до електричног стреса.[10] Киселина и база деле електронски пар који је претходно припадао бази.[10] Резултат тога је формирање високог диполног момента, који се једино може пореметити променом аранжмана атома у молекулу.[10]
Базе као катализатори
Базне супстанце се могу користити као нерастворни хетерогени катализатори хемијских реакција. Неки од примера су метални оксиди као што су магнезијум оксид, калцијум оксид, и баријум оксид као и калијум флуорид на алумини и поједини зеолити. Многи прелазни метали су добри катализатори, а знатан број њих су базне субстанце. Базни катализатори су коришћени за хидрогенације, миграције двоструких веза, у Мирвејн-Пондорф-Верлејовој редукцији, Мајкловој реакцији, и мноштву других реакција. и могу да буду веома активни катализатори на високим температурама.[21]
Чврсте базе
Примери чврстих база су:
- Смеше оксида: [22]
- Имобилисане базе: на силици; на алумини; на силици или алумини[22]
- Неорганске хемикалије: [22]
- Анјонски размењивачки резини[22]
- Угаљ који је третиран на 900 °C или активиран са [22]
Способност чврсте површине да успешно формира коњуговану базу путем апсорпције електрично неутралне киселине одређује базну јачину површине.[21] Број базних места по јединици површине чврсте материје се користи за изражавање количине базе присутне на чврстим катализаторима.[21] Научници су развили методе мерења количине базних места: титрацијом са бензојевом киселином користећи индикаторе и адсорпцијом киселине у гасном стању.[21] Чврста материја са довољном базном јачином ће апсорбовати електрично неутрални кисели индикатор и он ће попримити боју која је карактеристична за коњуговану базу.[21] При примени гасно киселинског адсорптивног метода се користи азот оксид.[21] Базна места се затим одређују користећи количину апсорбованог угљен-диоксида.[21]
Слабе базе
Кад постоји градијент водоничних јона између два места биолошке мембране, концентрација неких слабих база је усредсређена на само једну страну мембране.[23] Слабе базе имају тенденцију да се накупљају у киселим флуидима.[23] Желудачна киселина садржи већу концентрацију слабе базе од плазме.[23] Кисели урин, у поређењу са алкалним урином, брже излучује слабе базе.[23]
Употреба база
- Натријум хидроксид се користи у производњи сапуна, папира и синтетичких влакна званих вештачка свила.
- Калцијум хидроксид (гашени креч) се користи за производњу праха за избељавање.
- Калцијум хидроксид се такође користи за уклањање сумпор-диоксида, који је састојак издувних гасова електрана и фабрика.[20]
- Магнезијум хидроксид се користи као 'антацид' за неутрализацију сувишне киселине у стомаку и лечење лошег варења.
- Натријум карбонат се користи као сода за испирање и за омекшавање тврде воде.
- Натријум хидроген карбонат се користи као пекарска сода у припреми хране, за прављења пекарског праха, као антацид за лечење сметњи у варењу, и у киселој соди апарата за гашење пожара.
Етимологија термина
Концепт базе проистиче из старијег алхемичарског појма „матрица“:
Сматра се да је термин „база“ први пут користио француски хемичар Луис Лемери 1717. године, као синоним за старији Парацелзусов термин „матрица“. У складу са шеснаесто-вековним анимизмом, Парацелсус је постулирао да природне соли настају унутар земље као резултат импрегнирања земљишне матрице или материце универзалном киселином ... Модерно значење термина и уопште унос у хемијски речник, се међутим обично приписују француском хемичару, Гијом Франсоа Руел ... Руел је експлицитно дефинисао неутралну со као продукт формиран сједињавањем киселине са другом супстанцом, било да је она у води растворна алкалија, испарљива алкалија, материја апсорбована у зељи, метал, или уље, која има способност да делује као „база“ у соли „дајући јој конкретну или чврсту форму“. Већина киселина које су биле познате у 18. веку су биле испарљиве течности или „спирити“ које се могу дестилисати, док су соли, по самој природи, биле кристалне материје. Стога је база супстанца која неутралише киселину, која наводно уништава испарљивост или спирит киселине, и која даје чврстоћу (и.е., даје чврсту основу) резултирајућој соли.
— William Jensen, The origin of the term "base"[14]
Примери база
- - натријумова база
- - калцијумова база
- - алуминијумова база
- - калијумова база
- - амонијачна база
- - гвожђе база
- - гвожђе база
- - бакар база
- - бакар база
- - магнезијумова база
Види још
Референце
Литература
Спољашње везе
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
 ,
,  ...
...![{\displaystyle \mathrm {[Al(OH)(H_{2}O)_{5}]^{2+}+H_{2}O\ \rightleftharpoons \ [Al(H_{2}O)_{6}]^{3+}+OH^{-}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/fbeee520b1856d43518456f69d3e0a1ebf4e02fd)