Изотопы кислорода
Из Википедии, свободной энциклопедии
Изотопы кислорода — разновидности химического элемента кислорода с разным количеством нейтронов в атомном ядре. Известно 18 изотопов кислорода с массовыми числами от 11 до 28 (количество протонов 8, нейтронов от 3 до 20). Ядерные изомеры неизвестны.
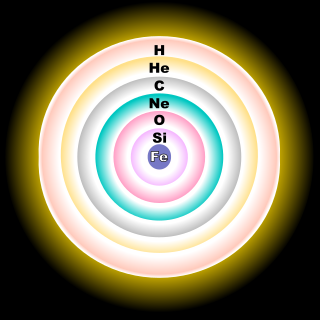
Природный кислород состоит из смеси 3 стабильных изотопов:
- 16O (изотопная распространенность 99,76 %)
- 17O (изотопная распространенность 0,04 %)
- 18O (изотопная распространенность 0,20 %)
Самый долгоживущий радиоактивный изотоп — 15O, его период полураспада — 122,24 секунды.
Стабильные изотопы
Суммиров вкратце
Перспектива
Природный кислород состоит из трёх стабильных изотопов, 16O, 17O и 18O, из них изотоп 16O является наиболее распространенным изотопом кислорода, 17O и 18O являются вторичными изотопами[1].
Кислород в атмосфере Земли на 99,759 % состоит из 16O, на 0,037 % из 17O и на 0,204 % из 18O[2].
Кислород-16
Преобладание изотопа 16O объясняется тем, что он образуется в процессе термоядерного синтеза, происходящего в звёздах[3].
Большая часть 16O образуется в конце процесса слияния гелия в звёздах. В ходе тройной альфа-реакции синтезируется изотоп 12C, который захватывает дополнительное ядро 4Не. Кроме того, 16O образуется при ядерном горении неона[3].
Кислород-17
17O образуется в основном в ходе CNO цикла и находится преимущественно в зоне горения водорода[3].
Кислород-18
Большая часть 18O образуется в реакции захвата изотопом 14N ядер 4Не с накоплением в гелиевой зоне звёзд[3]. Для слияния двух ядер кислорода и образования ядра серы требуется температура в миллиард кельвин[4].
Используется при синтезе 18F методом бомбардировки протонами мишеней с 18O в ускорителях. Для этого природный кислород обогащают по 18O до 95%. Разделение изотопов производится методом дистилляции и/или центрифугированием[5][6].
В атмосфере земли наблюдается повышенное содержание тяжелого изотопа 18О по сравнению с содержанием в морской водой, данное явление называется эффектом Доула, он возникает из-за того, что для дыхания предпочтительно используется более лёгкий, а значит и более реакционноспособный, 16O, что увеличивает относительный объём 18O в атмосфере.
Радиоизотопы
Суммиров вкратце
Перспектива
Известны также искусственные изотопы кислорода в диапазоне массовых чисел от 11[7] до 28[8]. Наиболее стабильны 15O[1] с периодом полураспада 122,24 с и 14O с периодом полураспада 70,606 с[1]. Все остальные радиоактивные изотопы имеют периоды полураспада менее 27 с, большинство из них имеют периоды полураспада менее 83 миллисекунд[1]. Например, 24O имеет период полураспада 61 мс[9].
Наиболее распространенные пути распада для лёгких изотопов является β+-распад (с образованием изотопов азота)[10][11][12], а для тяжелых изотопов — β- распад (с образованием изотопов фтора).
Кислород-13
Кислород-13 — нестабильный изотоп кислорода, ядро которого состоит из 8 протонов и 5 нейтронов. Спин ядра 3/2, период полураспада 8,58 мс. Атомная масса 13,0248 а. е. м. Он превращается в 13N путём электронного захвата с выделением энергии распада 17,765 МэВ[13]. Является продуктом распада фтора-14[14]. Был впервые получен Резерфордом при бомбардировке ядер азота альфа-частицами.
Кислород-15
Изотоп 15O используется в позитронно-эмиссионной томографии, но гораздо реже, чем 18F или 11С. Это объясняется слишком коротким периодом полураспада 15O. Ядро 15O состоит из 8 протонов, 7 нейтронов, атомная масса 15.0030654 а. е. м. Период полураспада — 122 секунды[15].
Таблица изотопов
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[16] (а. е. м.) |
Период полураспада[17] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[17] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 11O | 8 | 3 | 11,051250(60) | (1,98 ± (22))⋅10−22 с [2,31 ± 0,14] |
2p | 9C | (3/2−) | ||
| 12O | 8 | 4 | 12,034368(13) | (8,9 ± (33))⋅10−21 с | 2p (60,0%) | 10C | 0+ | ||
| 13O | 8 | 5 | 13,024815(10) | 8,58 ± (5) мс | β+ (89,1%) | 13N | (3/2−) | ||
| β+, p (10,9%) | 12C | ||||||||
| 14O | 8 | 6 | 14,008596706(27) | 70,621 ± (11) с | β+ | 14N | 0+ | ||
| 15O | 8 | 7 | 15,0030656(5) | 122,266 ± (43) с | β+ | 15N | 1/2− | ||
| 16O | 8 | 8 | 15,9949146193(3) | стабилен | 0+ | 0,99757(16) | 0,99738–0,99776 | ||
| 17O | 8 | 9 | 16,9991317560(7) | стабилен | 5/2+ | 3,8(1)⋅10−4 | (3,7–4,0)⋅10−4 | ||
| 18O | 8 | 10 | 17,9991596121(7) | стабилен | 0+ | 2,05(14)⋅10−3 | (1,88–2,22)⋅10−3 | ||
| 19O | 8 | 11 | 19,0035780(28) | 26,470 ± (6) с | β− | 19F | 5/2+ | ||
| 20O | 8 | 12 | 20,0040754(9) | 13,51 ± (5) с | β− | 20F | 0+ | ||
| 21O | 8 | 13 | 21,008655(13) | 3,42 ± (10) с | β− | 21F | (5/2+) | ||
| 22O | 8 | 14 | 22,00997(6) | 2,25 ± (9) с | β− (>78%) | 22F | 0+ | ||
| β−, n (<22%) | 21F | ||||||||
| 23O | 8 | 15 | 23,01570(13) | 97 ± (8) мс | β− (93%) | 23F | 1/2+ | ||
| β−, n (7%) | 22F | ||||||||
| 24O | 8 | 16 | 24,01986(18) | 77,4 ± (45) мс | β− (57%) | 24F | 0+ | ||
| β−, n (43%) | 23F | ||||||||
| 25O | 8 | 17 | 25,02934(18) | (5,18 ± (0,35))⋅10−21 с | n | 24O | 3/2+# | ||
| 26O | 8 | 18 | 26,03721(18) | 4,2(33)⋅10-12 с | 2n | 24O | 0+ | ||
| 27O | 8 | 19 | 27,04796(54)# | <260 нс | n | 26O | 3/2+# | ||
| 28O | 8 | 20 | 28,05591(75)# | <100 нс | 2n | 26O | 0+ | ||
Пояснения к таблице
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами 'm', 'n', 'p' (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом, обозначены стабильные продукты распада.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
См. также
Примечания
Литература
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
